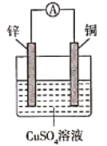
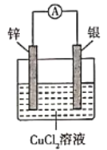
题目内容
【题目】下列关于晶体的说法中,正确的有( )
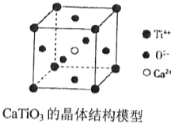
(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
①分子晶体中都存在共价键②在晶体中只要有阳离子就一定有阴离子③铯、钾、钠、钠-钾合金的熔点依次降低④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键⑤CaTiO3晶体中(晶胞结构如上图所示)每个Ti4+和12个O2-相紧邻⑥12g石墨中含有的C-C键的个数为1.5NA(NA为阿伏加德罗常数)⑦晶体中分子间作用力越大,分子越稳定⑧离子晶体CaO的晶格能比KCl高,熔点KCl比CaO低
A. 2种B. 3种C. 4种D. 5种
【答案】B
【解析】
①稀有气体分子形成的晶体没有化学键,故①错误;
②在晶体中只要有阴离子就一定有阳离子,但在晶体中有阳离子不一定有阴离子,如金属晶体由金属阳离子与自由电子构成,故②错误;
③碱金属单质自上而下原子半径逐渐增大,金属键逐渐减弱,单质的熔点逐渐降低,所以铯、钾、钠的熔点依次升高,故③错误;
④离子晶体中一定含有离子键,可能含有共价键,分子晶体中肯定没有离子键,故④错误;
⑤根据CaTiO3晶胞的结构可知,Ti4+周围的O2-分布在经过该Ti4+的各个面的面心上,这样的面共有12个,所以每个Ti4+与12个O2-紧相邻,故⑤正确;
⑥12g石墨中碳原子的物质的量为![]() =1mol,石墨中每个碳原子形成3个C-C键,每个C-C键为2个碳原子共用,含有的C-C键的物质的量为
=1mol,石墨中每个碳原子形成3个C-C键,每个C-C键为2个碳原子共用,含有的C-C键的物质的量为![]() =1.5mol,则含有的C-C键的个数为1.5NA,故⑥正确;
=1.5mol,则含有的C-C键的个数为1.5NA,故⑥正确;
⑦分子间作用力影响物理性质,分子稳定性为化学性质,化学键强弱影响分子稳定性,故⑦错误;
⑧钙离子电荷比钾离子多,半径比钾离子小,氧离子电荷比氯离子多,半径比氯离子小,故CaO的晶格能比KCl高,则熔点KCl比CaO低,故⑧正确。
所以说法正确的有3种。
故选B。

 巧学巧练系列答案
巧学巧练系列答案【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态O原子的电子排布图为_______,基态O原子电子占据最高能级的电子云轮廓图为____形,O原子最外层电子的运动状态有_____种。
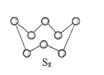
(2)下图为S8的结构,该分子中S原子的杂化轨道类型为______________。其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为_____________。
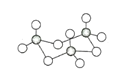
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形;固体三氧化硫中存在如下图所示的三聚分子,该分子中S原子的价层电子数___________。
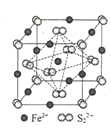
(4)FeS2晶体的晶胞如图所示。晶胞中有Fe2+_____个,有S22-_____个,晶胞中Fe2+位于S22-所形成的____(填空隙名称)的体心。晶胞边长为a nm、FeS2相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________gcm﹣3。
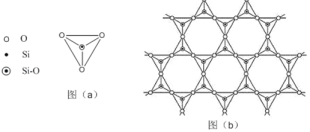
(5)在硅酸盐中,SiO44﹣四面体(如下图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长层状结构的多硅酸根;其中Si原子的杂化形式为____。该多硅酸根的化学式为_____。