��Ŀ����
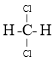
����Ŀ������������ѧ���㣬����̼�ṹ�����֣�����һ����-����̼Ӳ�ȳ������ʯ���壬��Ϊ����һָ�ij�Ӳ�²��ϣ���֪�õ���̼�Ķ�ά����ṹ��ͼ��ʾ�������йص���̼��˵������ȷ����
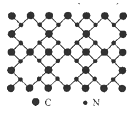
A. �þ����е�̼����ԭ�Ӻ��ⶼ����8�����ȶ��ṹ
B. ����̼��̼��+4�ۣ�����-3��
C. ÿ��̼ԭ�����ĸ���ԭ��������ÿ����ԭ�Ӻ�����̼ԭ������
D. ����̼�ķ���ʽΪC3N4
���𰸡�D
��������
A.����ͼ�нṹ��֪��ÿ��̼ԭ����Χ���ĸ����ۼ���ÿ����ԭ����Χ���������ۼ���̼ԭ���������4�����ӣ��γ��ĸ����۽����8�����ȶ��ṹ����ԭ���������5�����ӣ��γ��������ۼ���Ҳ��8�����ȶ��ṹ��A��ȷ��
B.����Ԫ�صķǽ�����N>C�������γɹ��ۼ�ʱ�����õ��Ӷ�ƫ��N��ƫ��C�����Ե���̼��̼��+4�ۣ�����-3�ۣ�B��ȷ��
C.���ݾ���ṹ��֪ÿ��̼ԭ�����ĸ���ԭ��������ÿ����ԭ�Ӻ�����̼ԭ��������C��ȷ��
D.���ڵ���̼��ԭ�Ӿ��壬�����ڷ��ӣ����û�з���ʽ��D����
�ʺ���ѡ����D��

��ϰ��ϵ�д�
 �ǻۿ����ܾ�100�ֵ�Ԫ���ؼ��ϵ�д�
�ǻۿ����ܾ�100�ֵ�Ԫ���ؼ��ϵ�д� ��Ԫ������ĩ��ϵ�д�
��Ԫ������ĩ��ϵ�д�
�����Ŀ