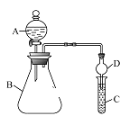
��Ŀ����
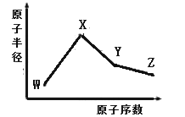
����Ŀ����֪V��Ԫ�����ڱ���ԭ�Ӱ뾶��С��ԭ�ӡ���W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ���ԭ�Ӱ뾶��ԭ�������仯��ͼ��ʾ��X �� Ne �ĺ�����������1���� X��W���γɻ�����X2W�� ��Z���ڵ������У�Z Ԫ�ص�����������ˮ����������ǿ������Ԫ�ص�����������֮��Ϊ18�� ��ش��������⣺
(1) YԪ��λ��Ԫ�����ڱ���λ��Ϊ____________��
(2)��֪Uԭ����V��ͬ����Ķ����ڵ�Ԫ�أ�����U��V���Ӿ�����ͬ�ĵ��Ӳ�ṹ�������ӵİ뾶��С�ǣ�____________(д���ӷ���)
(3) Z��ͬ����⻯���У��е���ߵ���________(д��ѧʽ)��ԭ��_______________________��
(4) W��X��Z ����Ԫ���γɾ���Ư���ԵĻ�����ĵ���ʽΪ___________��W�������⻯��ṹʽ�ֱ�Ϊ____________��______________��
(5) Y��Z�γɵĻ�����YZ4�ڳ�������һ��Һ̬����������ˮ��Ӧ������һ�������һ��ǿ�ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪ__________________________��
���𰸡���������IVA�� H-��Li+ HF HF����֮�������� ![]() H-O-H H-O-O-H SiCl4 + 3H2O = H2SiO3�� + 4HCl
H-O-H H-O-O-H SiCl4 + 3H2O = H2SiO3�� + 4HCl
��������
��֪V��Ԫ�����ڱ���ԭ�Ӱ뾶��С��ԭ�ӣ���H��W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ�����ͼʾ�����ݰ뾶X��Y��Zλ��ͬһ���ڣ���X��Y��Z����Z���ڵ������У�Z Ԫ�ص�����������ˮ����������ǿ��ZΪCl�� X �� Ne �ĺ�����������1��XΪNa���� X��W���γɻ�����X2W����WΪO������Ԫ�ص�����������֮��Ϊ18��YΪSi��Ȼ�������
���ݷ�����֪��V��W��X��Y��Z�ֱ�ΪH��O��Na��Si��Cl��
(1) YԪ���ǹ裬λ��Ԫ�����ڱ���λ��Ϊ��������IVA�壻
(2) V��H�� Uԭ����V��ͬ����Ķ����ڵ�Ԫ�أ�����ΪLi��Na������U��V���Ӿ�����ͬ�ĵ��Ӳ�ṹ��UΪLi�������ӵİ뾶��С�ǣ�H-��Li+ ��
(3) Z��ͬ����⻯���У��е���ߵ���HF ��HF����֮����������
(4) W��X��Z ����Ԫ���γɾ���Ư���ԵĻ�����Ϊ�������ƣ����ĵ���ʽΪ![]() ��W�������⻯��ֱ�Ϊˮ�������⣬�ṹʽ�ֱ�ΪH-O-H�� H-O-O-H��
��W�������⻯��ֱ�Ϊˮ�������⣬�ṹʽ�ֱ�ΪH-O-H�� H-O-O-H��
(5) SiCl4�ڳ�������һ��Һ̬����������ˮ��Ӧ������Ԫ���غ㣬�ж�������Ϊ��������ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪSiCl4 + 3H2O = H2SiO3�� + 4HCl��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�