题目内容
科学家在最新“人工固氮”的研究报道认为在常温、常压、光照条件下,N2在催化剂表面与水发生下列反应:
2N2(g)+6H2O(l)═4NH3 (g)+3O2(g)△H
上述反应NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“>”“=”);
(2)若该反应在恒容下达到平衡,判断该反应达到平衡的依据为 (填字母):
A.压强不随时间改变 B.气体的密度不随时间改变
C.c(H2O)不随时间改变 D.单位时间里生成NH3和O2的物质的量之比4:3.
2N2(g)+6H2O(l)═4NH3 (g)+3O2(g)△H
上述反应NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(2)若该反应在恒容下达到平衡,判断该反应达到平衡的依据为
A.压强不随时间改变 B.气体的密度不随时间改变
C.c(H2O)不随时间改变 D.单位时间里生成NH3和O2的物质的量之比4:3.
考点:化学平衡的影响因素,化学平衡建立的过程
专题:化学平衡专题
分析:(1)化学平衡常数表达式为:K=
;图表分析温度升高氨气的平衡浓度增大,说明正反应是吸热反应;
(2)平衡状态的判断依据主要有正逆反应速率相等和各组分的浓度保持不变.
| 生成物浓度幂次方 |
| 反应物浓度幂次方 |
(2)平衡状态的判断依据主要有正逆反应速率相等和各组分的浓度保持不变.
解答:
解:(1)化学平衡常数表达式为:K=
=
;图表分析温度升高氨气的平衡浓度增大,说明正反应是吸热反应,
故答案为:
;△H>0;
(2)A、反应前后气体体积有变化,压强不变说明正逆反应速率相等,故A正确;
B、因为水是液态,密度不变说明水的量不再发生变化,反应达到平衡状态,故B正确;
C、水是液态,其浓度是常数,不随时间改变,所以c(H2O)不随时间改变不能说明反应达到平衡状态,故C错误;
D、生成NH3和O2的物质的量之比4:3,不能说明反应达到平衡状态,故D错误;
故选:AB.
| 生成物浓度幂次方 |
| 反应物浓度幂次方 |
| [NH3]4?[O2]3 |
| [N2]2 |
故答案为:
| [NH3]4?[O2]3 |
| [N2]2 |
(2)A、反应前后气体体积有变化,压强不变说明正逆反应速率相等,故A正确;
B、因为水是液态,密度不变说明水的量不再发生变化,反应达到平衡状态,故B正确;
C、水是液态,其浓度是常数,不随时间改变,所以c(H2O)不随时间改变不能说明反应达到平衡状态,故C错误;
D、生成NH3和O2的物质的量之比4:3,不能说明反应达到平衡状态,故D错误;
故选:AB.
点评:本题考查了平衡常数表达式、吸热反应的判断、外界条件对化学平衡移动的影响,题目难度中等.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
下列叙述正确的是( )
| A、CO2、NO2、SO2都能与H2O反应,其反应原理相同 |
| B、铜片加入氯化铁溶液中发生反应:3Cu+2Fe3+=3Cu2++2Fe |
| C、FeCl2、Fe(OH)3、Cu2S均可通过化合反应制得 |
| D、在pH=1溶液中,NH4+、K+、ClO-、Cl-可以大量共存 |
正确掌握化学用语是学好化学的基础,下列有关表述正确的是( )
| A、H、D、T互为同素异形体 |
| B、氨分子中的化学键为非极性共价键 |
C、NH4Cl的电子式: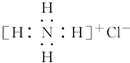 |
D、S2-的结构示意图: |

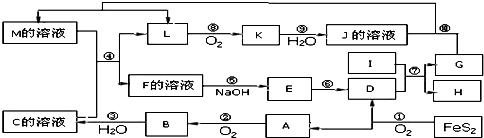
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: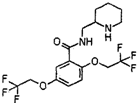 ,它可由龙胆酸(
,它可由龙胆酸(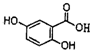 ,为原料合成,合成的方法如图:
,为原料合成,合成的方法如图: