题目内容
如图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出).其中,I是地壳中含量最高的金属,K是一种红棕色气体,M的溶液呈浅绿色.
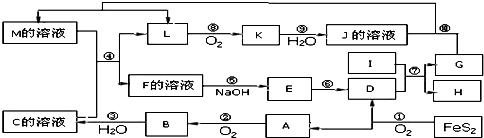
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第 周期第 族.
(2)在反应⑦中还原剂与氧化剂的物质的量之比为 .
(3)某同学取F的溶液,加入KI、淀粉溶液,变为蓝色.写出与上述变化过程相关的离子方程式 .
(4)将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效K2FeO4(高铁酸钾).同时还生成KNO2和H2O.该反应的化学方程式是 ,每消耗0.5mol的化合物D转移电子的物质的量为 mol.
(5)镁与I的合金是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、I单质在一定温度下熔炼获得.
①熔炼制备镁I合金时通入氩气的目的是 .
②I电池性能优越,I-空气海水电池可用作电源,该电池正极反应式为 .

请填写下列空白:
(1)在周期表中,组成单质G的元素位于第
(2)在反应⑦中还原剂与氧化剂的物质的量之比为
(3)某同学取F的溶液,加入KI、淀粉溶液,变为蓝色.写出与上述变化过程相关的离子方程式
(4)将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效K2FeO4(高铁酸钾).同时还生成KNO2和H2O.该反应的化学方程式是
(5)镁与I的合金是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、I单质在一定温度下熔炼获得.
①熔炼制备镁I合金时通入氩气的目的是
②I电池性能优越,I-空气海水电池可用作电源,该电池正极反应式为
考点:无机物的推断
专题:推断题
分析:I是地壳中含量最高的金属,应为Al;由反应①为4FeS2+11O2
2Fe2O3+8SO2知A、D为Fe2O3、SO2中的一种,结合A+O2 →B知,A为SO2,D为Fe2O3,B为SO3,C为H2SO4;G、H为Al2O3和Fe中的一种;由K是一种红棕色气体可知K为NO2,J为HNO3,L为NO;又由G+HNO3 →M+NO↑分析知G为Fe,H为Al2O3;M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2;F为Fe(NO3)3或Fe2(SO4)3;E应为Fe(OH)3,至此全部物质已确定,题目所涉及的问题可顺利解决.
| ||
解答:
解:I是地壳中含量最高的金属,应为Al;由反应①为4FeS2+11O2
2Fe2O3+8SO2知A、D为Fe2O3、SO2中的一种,结合A+O2 →B知,A为SO2,D为Fe2O3,B为SO3,C为H2SO4;G、H为Al2O3和Fe中的一种;由K是一种红棕色气体可知K为NO2,J为HNO3,L为NO;又由G+HNO3 →M+NO↑分析知G为Fe,H为Al2O3;M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2;F为Fe(NO3)3或Fe2(SO4)3;E应为Fe(OH)3,
(1)由以上分析可知G为Fe,位于周期表第四周期Ⅷ族,故答案为:四;Ⅷ;
(2)反应⑦为铝热反应,方程式为2Al+Fe2O3
Al2O3+2Fe,由方程式可知,还原剂与氧化剂的物质的量之比为2:1,
故答案为:2:1;
(3)F的溶液,加入KI、淀粉溶液,变为蓝色,离子反应为2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2;
(4)反应物与生成物已知,该反应为Fe2O3+3KNO3+4KOH
2K2FeO4+3KNO2+2H2O,则消耗0.5mol的化合物D转移电子的物质的量为0.5mol×2×(6-3)=3mol,
故答案为:Fe2O3+3KNO3+4KOH
2K2FeO4+3KNO2+2H2O;3;
(5)①Mg、Al 是活泼金属易被氧化,故熔炼制备镁铝合金时常需通入氩气作保护气,目的是防止Mg、Al被空气氧化,
故答案为:防止Mg、Al被空气氧化;
②I-空气海水电池可用作电源,则正极上氧气得到电子,电极反应为O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-.
| ||
(1)由以上分析可知G为Fe,位于周期表第四周期Ⅷ族,故答案为:四;Ⅷ;
(2)反应⑦为铝热反应,方程式为2Al+Fe2O3
| ||
故答案为:2:1;
(3)F的溶液,加入KI、淀粉溶液,变为蓝色,离子反应为2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2;
(4)反应物与生成物已知,该反应为Fe2O3+3KNO3+4KOH
| ||
故答案为:Fe2O3+3KNO3+4KOH
| ||
(5)①Mg、Al 是活泼金属易被氧化,故熔炼制备镁铝合金时常需通入氩气作保护气,目的是防止Mg、Al被空气氧化,
故答案为:防止Mg、Al被空气氧化;
②I-空气海水电池可用作电源,则正极上氧气得到电子,电极反应为O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-.
点评:本题考查无机物的推断,题目较为综合,涉及原子的构成、元素周期表的位置、铝热反应、金属的腐蚀以及电化学知识,侧重于元素化合物的考查,根据题给信息以及物质的转化关系为解答该题的关键.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、在氧化还原反应中,金属单质一般只作还原剂 |
| B、氧化还原反应中非金属单质一定是氧化剂 |
| C、金属元素被还原时所得产物一定是金属单质 |
| D、某元素从化合态变为游离态,该元素一定被还原 |
据报道N5是破坏力极强的炸药之一,18O2比黄金还贵重的物质.下列说法正确的是( )
| A、18O2中含18个中子 |
| B、18O2与16O2性质完全相同 |
| C、N5和N2互为同位素 |
| D、2N5═5N2是化学变化 |
 合成氨对农业生产及国防建设均具有重要意义.
合成氨对农业生产及国防建设均具有重要意义.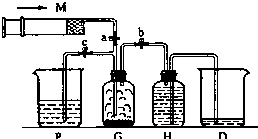 某课外活动小组利用下列装置迅速制备少量氯气.提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体.(2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)试回答:
某课外活动小组利用下列装置迅速制备少量氯气.提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体.(2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)试回答: