题目内容
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取低碳醇的热力学数据:
反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
反应Ⅱ:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.6kJ?mol-1

(1)写出由CH3OH(g)合成CH3CH2OH(g)的热化学反应方程式: .
(2)对反应Ⅰ,在一定温度下反应达到平衡的标志是 (选填编号).
a.反应物不再转化为生成物 b.平衡常数K不再增大
c.CO2的转化率不再增大 d.混合气体的平均相对分子质量不再改变
(3)在密闭容器中,反应Ⅰ在一定条件达到平衡后,其它条件恒定,能提高CO2转化率的措施是 (选填编号).
A、降低温度 B、补充CO2 C、加入催化剂 D、移去甲醇
(4)研究员以生产乙醇为研究对象,在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图1所示.表示CH3CH2OH组分的曲线是 ;图2中曲线Ⅱ和Ⅲ的交点a对应的体积分数ya= %(计算结果保留三位有效数字).
(5)一种以甲醇作燃料的电池示意图如图2.写出该电池放电时负极的电极反应式: .
反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
反应Ⅱ:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.6kJ?mol-1

(1)写出由CH3OH(g)合成CH3CH2OH(g)的热化学反应方程式:
(2)对反应Ⅰ,在一定温度下反应达到平衡的标志是
a.反应物不再转化为生成物 b.平衡常数K不再增大
c.CO2的转化率不再增大 d.混合气体的平均相对分子质量不再改变
(3)在密闭容器中,反应Ⅰ在一定条件达到平衡后,其它条件恒定,能提高CO2转化率的措施是
A、降低温度 B、补充CO2 C、加入催化剂 D、移去甲醇
(4)研究员以生产乙醇为研究对象,在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图1所示.表示CH3CH2OH组分的曲线是
(5)一种以甲醇作燃料的电池示意图如图2.写出该电池放电时负极的电极反应式:
考点:热化学方程式,化学电源新型电池,化学平衡的影响因素,化学平衡状态的判断,化学平衡的计算
专题:基本概念与基本理论
分析:(1)依据热化学方程式和盖斯定律计算得到;
(2)从化学平衡的定义来看,判断一个可逆反应是否达到平衡有两个标志:一是正逆反应速率相等,二是各组分的浓度不再变化;平衡常数随温度变化,依据平衡常数概念结合平衡常数变化和平衡移动原理分析平衡发生移动的方向;根据外界条件对反应速率的影响分析判断速率变化,提高物质转化率的方法是增加另一种物质,分离出生成物,改变温度、压强平衡正向进行;
(3)根据外界条件对反应速率的影响分析判断速率变化;提高物质转化率的方法是增加另一种物质,分离出生成物,改变温度、压强使平衡正向移动;
(4)反应为放热反应,升高温度平衡向吸热反应方向移动,即向逆反应移动,平衡时CO2与H2的含量增大,开始n(H2)/n(CO2)=3,H2与CO2反应按3:1进行,平衡时H2的含量是CO2的含量三倍,平衡时H2的含量比二氧化碳高;平衡时CH3CH2OH与H2O的含量降低,CH3CH2OH与H2O按1:3反应,平衡时H2O的含量是CH3CH2OH含量的三倍,平衡时H2O的含量高;a点为II和III的交点,设此时II C2H5OH体积为V,那么III H2也为V,根据方程式中的关系求出CO2和H2O的体积,再求体积分数ya;
(5)甲醇燃料在原电池中做负极失电子发生氧化反应.
(2)从化学平衡的定义来看,判断一个可逆反应是否达到平衡有两个标志:一是正逆反应速率相等,二是各组分的浓度不再变化;平衡常数随温度变化,依据平衡常数概念结合平衡常数变化和平衡移动原理分析平衡发生移动的方向;根据外界条件对反应速率的影响分析判断速率变化,提高物质转化率的方法是增加另一种物质,分离出生成物,改变温度、压强平衡正向进行;
(3)根据外界条件对反应速率的影响分析判断速率变化;提高物质转化率的方法是增加另一种物质,分离出生成物,改变温度、压强使平衡正向移动;
(4)反应为放热反应,升高温度平衡向吸热反应方向移动,即向逆反应移动,平衡时CO2与H2的含量增大,开始n(H2)/n(CO2)=3,H2与CO2反应按3:1进行,平衡时H2的含量是CO2的含量三倍,平衡时H2的含量比二氧化碳高;平衡时CH3CH2OH与H2O的含量降低,CH3CH2OH与H2O按1:3反应,平衡时H2O的含量是CH3CH2OH含量的三倍,平衡时H2O的含量高;a点为II和III的交点,设此时II C2H5OH体积为V,那么III H2也为V,根据方程式中的关系求出CO2和H2O的体积,再求体积分数ya;
(5)甲醇燃料在原电池中做负极失电子发生氧化反应.
解答:
解:(1)已知:反应I:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0 kJ?mol-1
反应II:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.6kJ?mol-1
根据盖斯定律Ⅱ-I×2得:2CH3OH(g)=CH3CH2OH(g)+H2O(g);△H=-75.6 kJ?mol-1;
故答案为:2CH3OH(g)=CH3CH2OH(g)+H2O(g)△H=-75.6 kJ?mol-1;
(2)反应Ⅰ,CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,反应是气体体积减小的放热反应,在一定温度下反应达到平衡的标志是正逆反应速率相同;在一定温度下反应达到平衡的标志是:
a.反应达到平衡状态是正逆反应仍在进行,所以不存在反应物不再转化为生成物的状态,故a错误;
b.平衡常数K只与温度有关,与是否达到平衡状态无关,故b错误;
c.CO2的转化率不再增大,即反应达到限度,是平衡状态,故c正确;
d.反应后气体的物质的量减少,质量不变,所以混合气体的平均相对分子质量逐渐增大,当混合气体的平均相对分子质量不再改变时即是平衡状态,故d正确;
故答案为:cd;
(3)其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是:
a、降低温度,反应速率减小,平衡正向进行,二氧化碳转化率增大,故a正确;
b、补充CO2,反应物的浓度增大,反应速率加快,二氧化碳转化率减小,故b错误;
c、加入催化剂 改变反应速率不改变化学平衡,故c错误;
d、移去甲醇,生成物浓度减小,速率降低,平衡向正反应移动,二氧化碳转化率增大,故d正确;
故答案为:ad;
(4)该反应为放热反应,升高温度平衡向逆反应移动,平衡时CO2与H2的含量增大,CH3CH2OH与H2O的含量降低.
开始n(H2)/n(CO2)=3,H2与CO2反应按3:1进行,平衡时H2的含量是CO2的含量三倍;
CH3CH2OH与H2O按1:3反应,平衡时H2O的含量是CH3CH2OH含量的三倍.
曲线Ⅰ、曲线Ⅱ随温度升高含量降低,且曲线Ⅱ的含量高,所以曲线Ⅰ表示CH3CH2OH、曲线Ⅱ表示H2O.
a点为II和III的交点,设此时II C2H5OH体积为V,那么III H2也为V,可知为CO2 为
V,H2O为C2H5OH的三倍,则为3V,
所以a对应的体积分数ya=
×100%=18.8%;
故答案为:Ⅰ;18.8%;
(5)依据图示分析,甲醇做负极失电子发生氧化反应,在熔融盐做电解质中发生的电极反应为:CH3OH+3O2--6e-=CO2+2H2O;
故答案为:CH3OH+3O2--6e-=CO2+2H2O.
反应II:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.6kJ?mol-1
根据盖斯定律Ⅱ-I×2得:2CH3OH(g)=CH3CH2OH(g)+H2O(g);△H=-75.6 kJ?mol-1;
故答案为:2CH3OH(g)=CH3CH2OH(g)+H2O(g)△H=-75.6 kJ?mol-1;
(2)反应Ⅰ,CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,反应是气体体积减小的放热反应,在一定温度下反应达到平衡的标志是正逆反应速率相同;在一定温度下反应达到平衡的标志是:
a.反应达到平衡状态是正逆反应仍在进行,所以不存在反应物不再转化为生成物的状态,故a错误;
b.平衡常数K只与温度有关,与是否达到平衡状态无关,故b错误;
c.CO2的转化率不再增大,即反应达到限度,是平衡状态,故c正确;
d.反应后气体的物质的量减少,质量不变,所以混合气体的平均相对分子质量逐渐增大,当混合气体的平均相对分子质量不再改变时即是平衡状态,故d正确;
故答案为:cd;
(3)其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是:
a、降低温度,反应速率减小,平衡正向进行,二氧化碳转化率增大,故a正确;
b、补充CO2,反应物的浓度增大,反应速率加快,二氧化碳转化率减小,故b错误;
c、加入催化剂 改变反应速率不改变化学平衡,故c错误;
d、移去甲醇,生成物浓度减小,速率降低,平衡向正反应移动,二氧化碳转化率增大,故d正确;
故答案为:ad;
(4)该反应为放热反应,升高温度平衡向逆反应移动,平衡时CO2与H2的含量增大,CH3CH2OH与H2O的含量降低.
开始n(H2)/n(CO2)=3,H2与CO2反应按3:1进行,平衡时H2的含量是CO2的含量三倍;
CH3CH2OH与H2O按1:3反应,平衡时H2O的含量是CH3CH2OH含量的三倍.
曲线Ⅰ、曲线Ⅱ随温度升高含量降低,且曲线Ⅱ的含量高,所以曲线Ⅰ表示CH3CH2OH、曲线Ⅱ表示H2O.
a点为II和III的交点,设此时II C2H5OH体积为V,那么III H2也为V,可知为CO2 为
| 1 |
| 3 |
所以a对应的体积分数ya=
| V | ||
V+V+
|
故答案为:Ⅰ;18.8%;
(5)依据图示分析,甲醇做负极失电子发生氧化反应,在熔融盐做电解质中发生的电极反应为:CH3OH+3O2--6e-=CO2+2H2O;
故答案为:CH3OH+3O2--6e-=CO2+2H2O.
点评:本题考查了热化学方程式和盖斯定律计算,化学平衡影响因素分析判断,图象理解应用,原电池原理的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
下列有关元素的性质及其递变规律正确的是( )
| A、第二周期元素从左到右,最高正价从+1递增到+7 |
| B、ⅠA族与ⅦA族元素间既可形成共价化合物,也可形成离子化合物 |
| C、同主族元素从上到下,元素的非金属性逐渐增强 |
| D、同周期金属元素的化合价越高,其原子失电子能力越强 |
下列叙述正确的是( )
| A、在氧化还原反应中,金属单质一般只作还原剂 |
| B、氧化还原反应中非金属单质一定是氧化剂 |
| C、金属元素被还原时所得产物一定是金属单质 |
| D、某元素从化合态变为游离态,该元素一定被还原 |
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、9g D2O中含有的电子数为5NA |
| B、92g NO2和N2O4混合气体中含有原子数为6NA |
| C、1mol C3H8分子中共价键总数为8NA |
| D、65g Zn全部溶解在一定浓度的硝酸溶液中,有NO生成,则转移的电子数为NA |
下列叙述错误的是( )
| A、乙醇(CH3CH2OH)和二甲醚(CH3OCH3)互为同分异构体 |
| B、CH2=CH-CH2-CH3和CH2=CH-CH=CH-CH2-CH3属于同系物 |
| C、石墨与C60是同素异形体 |
| D、1H、2H、3H是氢的三种同位素 |
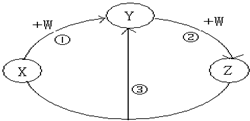 X、Y、Z、W都是中学化学常见的物质,其中X、Y、Z均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请按要求回答下列问题:
X、Y、Z、W都是中学化学常见的物质,其中X、Y、Z均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请按要求回答下列问题: 合成氨对农业生产及国防建设均具有重要意义.
合成氨对农业生产及国防建设均具有重要意义.