题目内容
下列叙述正确的是( )
| A、CO2、NO2、SO2都能与H2O反应,其反应原理相同 |
| B、铜片加入氯化铁溶液中发生反应:3Cu+2Fe3+=3Cu2++2Fe |
| C、FeCl2、Fe(OH)3、Cu2S均可通过化合反应制得 |
| D、在pH=1溶液中,NH4+、K+、ClO-、Cl-可以大量共存 |
考点:二氧化硫的化学性质,离子共存问题,氮的氧化物的性质及其对环境的影响,铁的氧化物和氢氧化物,铜金属及其重要化合物的主要性质
专题:元素及其化合物
分析:A.NO2与水发生氧化还原反应;
B.反应生成氯化亚铁和氯化铜;
C.Fe与氯化铁反应生成氯化亚铁,氢氧化亚铁、氧气、水化合生成氢氧化铁,Cu与S化合生成Cu2S;
D.pH=1溶液,显酸性,离子之间发生氧化还原反应.
B.反应生成氯化亚铁和氯化铜;
C.Fe与氯化铁反应生成氯化亚铁,氢氧化亚铁、氧气、水化合生成氢氧化铁,Cu与S化合生成Cu2S;
D.pH=1溶液,显酸性,离子之间发生氧化还原反应.
解答:
解:A.NO2与水发生氧化还原反应,而CO2、SO2都能与H2O反应生成酸为非氧化还原反应,其反应原理不相同,故A错误;
B.铜片加入氯化铁溶液中发生反应的离子反应为Cu+2Fe3+=Cu2++2Fe2+,故B错误;
C.Fe与氯化铁反应生成氯化亚铁,氢氧化亚铁、氧气、水化合生成氢氧化铁,Cu与S化合生成Cu2S,则均可通过化合反应制得,故C正确;
D.pH=1溶液,显酸性,H+、ClO-、Cl-离子之间发生氧化还原反应,不能大量共存,故D错误;
故选C.
B.铜片加入氯化铁溶液中发生反应的离子反应为Cu+2Fe3+=Cu2++2Fe2+,故B错误;
C.Fe与氯化铁反应生成氯化亚铁,氢氧化亚铁、氧气、水化合生成氢氧化铁,Cu与S化合生成Cu2S,则均可通过化合反应制得,故C正确;
D.pH=1溶液,显酸性,H+、ClO-、Cl-离子之间发生氧化还原反应,不能大量共存,故D错误;
故选C.
点评:本题考查较综合,涉及氧化还原反应、离子反应、离子共存及物质的性质等,注重高频考点的考查,综合性较强,题目难度不大,选项C为解答的难点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
常温下,下列溶液中可能大量共存的离子组是( )
| A、水电离产生的c(H+)=1×10-12mol/L的溶液中:AlO2-、S2-、PO43-、Na+ |
| B、加入金属镁能产生H2的溶液中:Na+、HCO3-、SO42-、Al3+ |
| C、能使Al溶解产生H2的溶液中:NH4+、Na+、SiO32-、CO32- |
| D、含有大量Fe2+的溶液中:K+、Mg2+、ClO-、SO42- |
下列有关实验现象的描述,正确的是( )
| A、在盛有苯的试管中加入几滴酸性KMnO4溶液,可观察到紫色褪去 |
| B、向鸡蛋清溶液中滴加饱和CuSO4溶液,有固体析出,再加入足量蒸馏水,固体可以重新溶解 |
| C、用灯光照射盛有CH4与Cl2(体积比1:4)的集气瓶后,可观察到瓶内壁附有液态物质 |
| D、将红热的铜丝迅速插入乙醇中,可观察到铜丝表面变黑,反复多次,并能闻到香味 |
据报道N5是破坏力极强的炸药之一,18O2比黄金还贵重的物质.下列说法正确的是( )
| A、18O2中含18个中子 |
| B、18O2与16O2性质完全相同 |
| C、N5和N2互为同位素 |
| D、2N5═5N2是化学变化 |
下列物质中不属于合金的是( )
| A、不锈钢 | B、白铜 |
| C、高碳钢 | D、金刚石 |
下列叙说正确的是( )
| A、一定温度下,若等浓度的NaA,NaB溶液,pH前者大于后者,则HA,HB的Ka前者小于后者 |
| B、在一定温度下的CaSO4的水溶液中,Ca2+和SO42-浓度的乘积是一定是常数 |
| C、常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为3c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) |
D、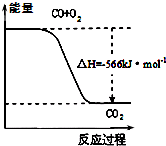 已知:2CO(g)+O2(g)=2CO2(g);△H=-566kJ?mol-1图可表示由CO生成CO2的反应过程和能量关系 |
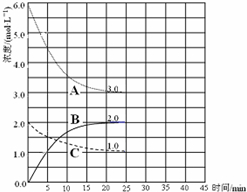 合成氨对农业生产及国防建设均具有重要意义.
合成氨对农业生产及国防建设均具有重要意义.