题目内容
(15分)
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是酸雨形成的主要物质。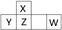
(1) 写出W的原子结构示意图: 。
(2) 将足量X的最高价氧化物通入含Y元素的阴离子溶液中。反应的离子方程式为 。
(3) 已知:①X(s) + O2(g) =XO2(g) ΔH=-393.5 kJ·mol-1
②H2(g) + 1/2 O2(g) =H2O(g) ΔH=-242.0 kJ·mol-1
③XH4(g) + 2O2(g) =XO2(g) + 2H2O(g) ΔH=-802.0 kJ·mol-1
则XH4气体分解成氢气和X固体的热化学方程式为 。
(4) ZO是由单质X和ZO2反应制取单质Z的中间产物。隔绝空气时,ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为_______________。
(5) 利用原电池原理,可用W的一种氧化物、O2和H2O来制备W的最高价氧化物对应水化物。写出该电池负极反应式:___________。
(6) 将W的气态氢化物通入一定量的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。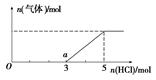
①O点溶液中所含溶质的化学式为____________。
②a点溶液中,c(Na+): c(Cl-)= _______________。
(1)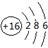 (2)AlO2-+ CO2 +2H2O = Al(OH)3↓+ HCO3-
(2)AlO2-+ CO2 +2H2O = Al(OH)3↓+ HCO3-
(3)CH4(g) =C (s) + 2H2(g);ΔH =+75.5 kJ·mol-1 (4)2SiO+ 2NaOH  Na2SiO3 + Si + H2O
Na2SiO3 + Si + H2O
(5)SO2 -2e-+ 2H2O = SO42-+ 4H+ (6)①Na2S、NaOH ②5 : 3
解析试题分析:根据题意可知这几种元素分别是:X是C;Y是Al;Z是Si;W是S。(1) S的原子结构示意图为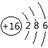 (2) 将足量CO2的最高价氧化物通入含AlO2-溶液中的反应的离子方程式为AlO2-+ CO2 +2H2O = Al(OH)3↓+ HCO3-.③-①-②×2整理可得CH4(g) =C (s) + 2H2(g);ΔH =+75.5 kJ·mol-1(4) ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为2SiO+ 2NaOH
(2) 将足量CO2的最高价氧化物通入含AlO2-溶液中的反应的离子方程式为AlO2-+ CO2 +2H2O = Al(OH)3↓+ HCO3-.③-①-②×2整理可得CH4(g) =C (s) + 2H2(g);ΔH =+75.5 kJ·mol-1(4) ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为2SiO+ 2NaOH  Na2SiO3 + Si + H2O(5) 利用原电池原理,可用W的一种氧化物、O2和H2O来制备W的最高价氧化物对应水化物。该反应的总方程式为2SO2+O2+2H2O=2H2SO4,,该电池负极反应式为SO2 -2e-+ 2H2O = SO42-+ 4H+ 。(6)①在NaOH的溶液中通入H2S,发生的反应:2NaOH+H2S=Na2S+2H2O.若二者恰好反应。则滴加HCl时应该是Na2S+HCl="NaCl+NaHS;" NaHS+HCl=NaCl+H2S↑.前后的盐酸消耗的体积相同。但是由于在开始产生气体时消耗HCl的体积为3,当气体达到最大值时体积为5,说明原固体中含有NaOH和Na2S。即O点溶液中所含溶质的化学式为NaOH和Na2S。②在O点溶液中所含溶质的化学式为NaOH和Na2S,当滴加HCl至完全反应时,根据元素守恒可得n(Na+)= n(Cl-)= 5;而在a至恰好反应还需要HCl的物质的量为2mol,因此在a点时溶液中的n(Cl-)=3.因此在a点溶液中,c(Na+): c(Cl-)= 5 : 3。
Na2SiO3 + Si + H2O(5) 利用原电池原理,可用W的一种氧化物、O2和H2O来制备W的最高价氧化物对应水化物。该反应的总方程式为2SO2+O2+2H2O=2H2SO4,,该电池负极反应式为SO2 -2e-+ 2H2O = SO42-+ 4H+ 。(6)①在NaOH的溶液中通入H2S,发生的反应:2NaOH+H2S=Na2S+2H2O.若二者恰好反应。则滴加HCl时应该是Na2S+HCl="NaCl+NaHS;" NaHS+HCl=NaCl+H2S↑.前后的盐酸消耗的体积相同。但是由于在开始产生气体时消耗HCl的体积为3,当气体达到最大值时体积为5,说明原固体中含有NaOH和Na2S。即O点溶液中所含溶质的化学式为NaOH和Na2S。②在O点溶液中所含溶质的化学式为NaOH和Na2S,当滴加HCl至完全反应时,根据元素守恒可得n(Na+)= n(Cl-)= 5;而在a至恰好反应还需要HCl的物质的量为2mol,因此在a点时溶液中的n(Cl-)=3.因此在a点溶液中,c(Na+): c(Cl-)= 5 : 3。
考点:考查元素的推断、原子结构示意图、离子方程式、热化学方程式的书写、原电池反应原理的应用及溶液中的成分的确定的知识。

A、B、C、D是元素周期表前四周期常见的四种元素,原子序数依次增大, 它们的相关结构和性质信息如下表所示,请结合相关信息,完成相关的问题:
| 元素 | 相关结构和性质 |
| A | A为非金属元素,其一种单质是电的良导体,难熔、质软并有润滑性,可用作电极材料 |
| B | 是蛋白质的组成元素之一,原子核外有三种不同能量的电子,且未成对电子数最多 |
| C | 其单质既能与强酸溶液应又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小 |
| D | D的高价氯化物的盐溶液常用于印刷电路极电路的“刻蚀” |
(1)D位于元素周期表第 周期第 族,其基态原子核外价电子排布式为 ;元素D的高价氯化物形成的盐溶液刻蚀印刷电路板电路所发生反应 的离子方程式为 ;
(2)钠与B元素形成的Na3B晶体属于 晶体(填“分子”、“原子”、“离子”)。 分析B元素的气态氢化物极易溶于水的原因,除了因为它们均是极性分子之外,还因为 ;
(3)元素A与元素B相比,非金属性较强的是 (用元素符号表示),可以作为判断两者非金属性强弱的依据的是 。
a.常温下A的单质和B的单质状态不同
b.该两种原子形成的共价键中共用电子对的偏向
c.最高价氧化物对应水化物的酸性强弱
d.单质与酸反应的难易程度
(4)已知毎5.4g元素C的单质可与元素D的低价氧化物反应,放出346.2kJ的热量。试写出该反应的热化学方程式: 。
(13分)近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
(1)铬元素的基态原子的价电子层排布式是 。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
(3)Mn和Fe的部分电离能数据如表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(4)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。
某镍配合物结构如右图所示,分子内含有的作用力
有 (填序号)。
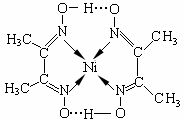
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是 。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是
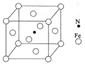
(6)铁能与氮形成一种磁性材料,其晶胞结构如右图所示,则该磁性材料的化学式为
下列关于σ键和π键的理解不正确的是( )
| A.σ键能单独形成,而π键一定不能单独形成 |
| B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转 |
| C.HCl 分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的 |
| D.气体单质中一定存在σ键,可能存在π键 |
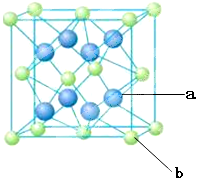
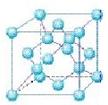 硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。