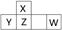
题目内容
(13分)近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
(1)铬元素的基态原子的价电子层排布式是 。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
(3)Mn和Fe的部分电离能数据如表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(4)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。
某镍配合物结构如右图所示,分子内含有的作用力
有 (填序号)。

A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是 。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是
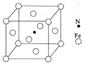
(6)铁能与氮形成一种磁性材料,其晶胞结构如右图所示,则该磁性材料的化学式为
(1)3d54S1 (2) sp3
(3)Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态。)
(4) ACE; N>O>C; (5) 分子晶体 (6)Fe4N
解析试题分析:(1)原子处于全充满、半充满或全空时是稳定的状态。24号铬元素的基态原子的价电子排布式是3d54S1。(2)C元素Si元素组成的SiC晶体是原子晶体。其中的C原子的杂化方式为sp3。(3)根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态)。(4)在某镍配合物中含有共价键、配位键、氢键。选项为ACE。组成该配合物分子且同属第二周期元素有C、N、O。一般情况下,元素的非金属性越强,原子半径越小,元素的电负性就越大。但是对于N原子来说,由于其最外层电子处于半充满的稳定状态,所以失去电子需要的能量比O还多。因此这三种元素的电负性由大到小的顺序是N>O>C。(5) 根据四羰基镍的性质可推知该晶体所以分子晶体。(6)Fe:8×1/8+6×1/2=4;N:1。因此该磁性材料的化学式为Fe4N。
考点:考查原子结构、原子的杂化、元素电负性和第一电离能的比较、物质的结合力、晶体化学式的确定。

A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如下表:
| 元素 | 有关性质或结构信息 |
| A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B | B原子得到一个电子后3p轨道全充满 |
| C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体 |
| E | E元素的核电荷数等于A原子和B元素氢化物的核电荷数之和 |
(2)E元素原子的核外电子排布式为
(3)盐X的水溶液呈 (填“酸性”、“碱性”或“中性”),B元素最高价含氧酸一定比D元素最高价含氧酸的酸性 (填“强”或“弱”)。
(4)C单质分子中σ键和π键的个数比为 ,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式: 。写出该阳离子与硫的氢化物的水溶液反应的离子方程式:
下表是元素周期表的一部分,根据表中10种元素,用元素符号或化学式填空。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | | ② | | |
| 3 | | | ③ | ④ | | ⑤ | ⑥ | ⑦ |
| 4 | ⑨ | ⑧ | | | | ⑩ | | |
(1)①~⑩元素中,金属性最强的是 ;化学性质最不活泼的是 。
(2)①~⑩元素中,最高价氧化物水化物呈两性的是 ,该化合物与NaOH溶液反应的离子方程式为 ;
(3)①~⑩元素中,最高价氧化物水化物酸性最强的是 ,碱性最强的是 ;
(4)⑤、⑥、⑧、⑨所形成的离子,其半径由小到大的顺序是 。
(14分)元素周期表是学习化学的重要工具,它隐含着许多信息和规律,下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)B元素在元素周期表中的位置___________________,上述八种元素的最高价氧化物对应的水化物中酸性最强的是__________,A离子的结构示意图_______________。
(2)用电子式表示A、D形成化合物的过程:____________________________________。H、E形成原子个数比为1:1的化合物的电子式为___________,含有的化学键类型为____________。C2D2的电子式为______________________。
(3)下列说法能说明D的非金属性比C强的选项____________
①H2CO4比HDO稳定②HDO4比H2CO4酸性强③C2-比D-易被氧化④HD比H2C稳定⑤铜与HD不反应,但能与浓H2CO4反应⑥铁与D2加热生成FeD3,铁与C加热生成FeC⑦C原子与D原子电子层数相同,D原子半径小于C原子。
A、全部 B、②③④⑥⑦ C、①②④⑤⑥ D、除①以外
(4)A、B、C、D、E形成的简单离子半径由大到小的顺序为_______________________。(用具体离子符号表示)
(5)C单质与H的最高价氧化物对应水化物在加热条件下能发生反应,若有3mol的C参与反应,转移4NA的电子,请写出离子反应方程_______________________________________,氧化剂与还原剂的质量之比_____________________。
关于离子键、共价键的各种叙述中,下列说法正确的是 ( )
| A.在离子化合物里,只存在离子键,没有共价键 |
| B.非极性键只存在于双原子的单质分子(如Cl2)中 |
| C.在共价化合物分子内,一定不存在离子键 |
| D.由不同元素组成的多原子分子里,一定只存在极性键 |

 ,每个晶胞中分摊2个钾原子
,每个晶胞中分摊2个钾原子 Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。