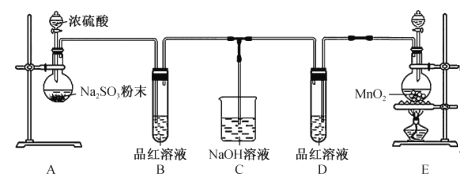
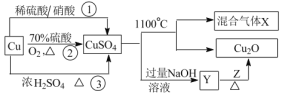
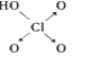
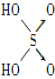题目内容
【题目】化合物 A是一种化肥,受热分解生成三种物质,物质间的有关转换关系如图所示,部分生成物已省略,其中C为无色气体,B为无色液体,D 为无色有刺激性气味的气体,B到E的反应条件为通电,I为一种常见强酸。
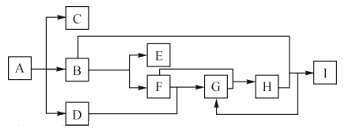
请回答下列问题:
(1)A的化学式为___________________________。
(2)C的水化物与I的酸性由强到弱的顺序:___________________(用化学式填空)
(3)B生成E的化学方程式为_____________________。
(4)金属铜与I的稀溶液反应的离子方程式为_____________,该反应中还原产物是 ______,生成1mo1的还原产物,转移电子的数目为__________NA。
【答案】NH4HCO3或(NH4)2CO3 HNO3>H2CO3 2H2O ![]() 2H2↑+O2↑ 3Cu+8H+ +2NO3-= 3Cu2+ +2NO↑+4H2O NO 3
2H2↑+O2↑ 3Cu+8H+ +2NO3-= 3Cu2+ +2NO↑+4H2O NO 3
【解析】
化合物 A是一种化肥,受热分解生成三种物质,其中C为无色气体,B为无色液体,D 为无色有刺激性气味的气体,A是碳酸氢铵或碳酸铵,C是二氧化碳,B是水,D是氨气,B到E的反应条件为通电,E是氢气,F是氧气,F和D反应生成G,G是一氧化氮,H为二氧化氮,I为一种常见强酸,是硝酸。
根据分析可知,A为碳酸氢铵或碳酸铵,C是二氧化碳,B是水,D是氨气,E是氢气,F是氧气,G是一氧化氮,H为二氧化氮,I为硝酸。
(1)A是碳酸氢铵或碳酸铵,化学式为NH4HCO3或(NH4)2CO3;
(2)C的水化物为碳酸,I为硝酸,N的非金属性强于C,故酸性:HNO3>H2CO3;
(3)B在通电的条件下生成E和F,化学方程式为电解水,2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
(4)铜与稀硝酸反应生成硝酸铜,一氧化氮和水,离子方程式为3Cu+8H++2NO3-= 3Cu2+ +2NO↑+4H2O,硝酸中的氮元素化合价从+5降低到+2,是氧化剂,得到的一氧化氮是还原产物,生成2molNO转移6mol电子,故生成1mo1的NO,转移3mol电子,数目为3NA。

 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
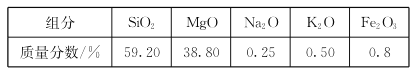
学而优暑期衔接南京大学出版社系列答案【题目】某实验兴趣小组按下图装置实验后,所记录内容合理的是( )
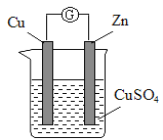
实验 记录 | ① Cu为正极,Zn为负极; ② Zn质量减少,Cu质量增加; ③ SO ④ 电子流方向是:由Zn经导线流入Cu片; ⑤ Zn电极发生还原反应; ⑥ 正极反应式:Cu2+ + 2e- = Cu |
A.②③④ B.①②④⑥ C.①②④⑤ D.②③⑤⑥
【题目】(1)CO(NH2)2分子中含有σ键与π键的数目之比为:______,N原子的杂化类型为______。
(2)类卤素(SCN)2与卤素性质相似,对应的酸有两种,理论上硫氰酸(HSC≡N)的沸点低于异硫氰酸(HN=C=S)的沸点,其原因是:_________________________。
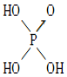
(3)S能形成很多种含氧酸根离子,如SO32-、SO42-、S2O72-,已知S2O72-的结构中所有原子都达到稳定结构,且不存在非极性键,由该离子组成二元酸的分子式为H2S2O7,试写出其结构式_____________________________。
(4)判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:含氧酸酸性强弱与非羟基氧原子数的关系。
次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
含氧酸 | Cl—OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
已知亚磷酸是中强酸,亚砷酸是弱酸且有一定的弱碱性,
则H3PO3与过量的NaOH溶液反应的化学方程式是:__________________________,
在H3AsO3中加入足量的浓盐酸,写出化学方程式:___________________________。