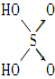题目内容
【题目】(1)CO(NH2)2分子中含有σ键与π键的数目之比为:______,N原子的杂化类型为______。
(2)类卤素(SCN)2与卤素性质相似,对应的酸有两种,理论上硫氰酸(HSC≡N)的沸点低于异硫氰酸(HN=C=S)的沸点,其原因是:_________________________。
(3)S能形成很多种含氧酸根离子,如SO32-、SO42-、S2O72-,已知S2O72-的结构中所有原子都达到稳定结构,且不存在非极性键,由该离子组成二元酸的分子式为H2S2O7,试写出其结构式_____________________________。
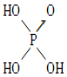
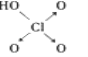
(4)判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:含氧酸酸性强弱与非羟基氧原子数的关系。
次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
含氧酸 | Cl—OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
已知亚磷酸是中强酸,亚砷酸是弱酸且有一定的弱碱性,
则H3PO3与过量的NaOH溶液反应的化学方程式是:__________________________,
在H3AsO3中加入足量的浓盐酸,写出化学方程式:___________________________。
【答案】7:1 sp3 异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键(或异硫氰酸分子间可形成氢键) 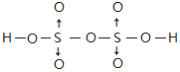 H3PO3+2NaOH=Na2HPO3+2H2O H3AsO3+3HCl=AsCl3+3H2O
H3PO3+2NaOH=Na2HPO3+2H2O H3AsO3+3HCl=AsCl3+3H2O
【解析】
(1)根据杂化轨道理论分析N原子的轨道杂化类型;
(2)根据二者的结构特点以及氢键对物质熔沸点的影响分析作答;
(3)H2S2O7属于二元酸,根据已知H2S2O7的结构特点分析其结构;
(4)根据无机含氧酸的酸性强弱规律分析亚磷酸和亚砷酸的结构,并分别写出相应的化学方程式。
(1)CO(NH2)2分子的结构式为![]() ,则其含有的σ键与π键的数目之比为7:1;N原子与其他3个原子形成3个σ键,且有一个孤电子对,则其价层电子对数为4,采取sp3杂化;
,则其含有的σ键与π键的数目之比为7:1;N原子与其他3个原子形成3个σ键,且有一个孤电子对,则其价层电子对数为4,采取sp3杂化;
(2)由异硫氰酸分子和硫氰酸分子的结构式可知,异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键,故硫氰酸(HSC≡N)的沸点低于异硫氰酸(HN=C=S)的沸点;
(3)含氧酸H2S2O7属于二元酸,已知其结构中所有原子都达到稳定结构,且不存在非极性键,即不存在氧原子之间、S原子之间形成的共价键,故S原子与氧原子之间形成共价键,O原子与H原子之间形成共价键,且每个S提供孤对电子与2个O原子形成2个配位键,其结构式为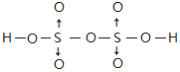 ;
;
(4)无机含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,亚磷酸是中强酸,亚砷酸是弱酸且有一定的弱碱性,所以亚磷酸含有一个非羟基氧原子,亚砷酸不含非羟基氧原子,则亚磷酸和亚砷酸的结构式分别为: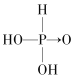 、
、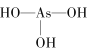 ,亚磷酸中含有2个羟基,属于二元酸,亚砷酸属于三元酸,但有弱碱性,则H3PO3与过量的NaOH溶液反应的化学方程式是:H3PO3+2NaOH=Na2HPO3+2H2O,H3AsO3与足量的浓盐酸反应的化学方程式是:H3AsO3+3HCl=AsCl3+3H2O。
,亚磷酸中含有2个羟基,属于二元酸,亚砷酸属于三元酸,但有弱碱性,则H3PO3与过量的NaOH溶液反应的化学方程式是:H3PO3+2NaOH=Na2HPO3+2H2O,H3AsO3与足量的浓盐酸反应的化学方程式是:H3AsO3+3HCl=AsCl3+3H2O。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案【题目】向容积均为0.5L的甲、乙、丙三个密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
容器 | 甲 | 乙 | 丙 |
温度/℃ | T1 | T2 | T2 |
反应物起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 3.0molA 1.0molB |
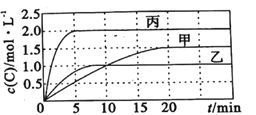
则: (1)该反应为____________(填 “放热反应”或“吸热反应”)
(2)丙容器中前5分钟的A的反应速率为__________
(3)该可逆反应达到平衡后,为在提高反应速率的同时提高B的转化率,可采取的措施有___________(填标号)。
a.按体积比1:1再充入A和B b.改用高效催化剂 c.升高温度 d.增加A的浓度 e. 增加C的浓度
(4)乙容器中的化学平衡常数为_____________