��Ŀ����
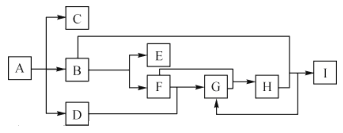
����Ŀ��ijУ��ѧ��ȤС��Ϊ̽���ͱȽ϶����������ˮ��Ư���ԣ��������ͼ��ʾ��ʵ��װ�á�
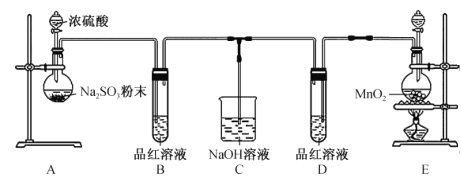
�ش��������⣺
(1)װ��A�з�Ӧ�Ļ�ѧ����ʽΪ____________________________________���Ʊ�SO2ʱѡ��Ũ���������ϡ�������Ҫԭ���� ____________________________��
(2)ʵ������װ��E�Ʊ�C12����Ӧ�����ӷ���ʽΪ __________________________������8.7gMnO2�μӷ�Ӧ����ת�Ƶĵ��ӵ����ʵ���Ϊ ______________��
(3)��Ӧ��ʼһ��ʱ��۲쵽װ��B��D�е�Ʒ����Һ���ֵ�������____________��
(4)С���м�ͬѧ��ΪSO2����ˮ����Ư���ԣ��������ʹ�ã�Ư���Ի��ǿ��Ϊ��֤��ͬѧ���ƶϣ���ͬ��ͬѹ�£�����ͬʱ��SO2��C12�����ͨ�뵽Ʒ����Һ�У��������Ʒ����Һ_____________(����ĸ����
a.�ܿ���ɫ b.��������ɫ c.����ɫ��ԭ
�������������ԭ����________________________________ (�û�ѧ����ʽ��ʾ����
���𰸡�Na2SO3+H2SO4(Ũ)= Na2SO4+H2O+SO2�� SO2��ˮ�е��ܽ�Ƚϴ� MnO2 +4H+ +2Cl-![]() Mn2+ +Cl����+2H2O 0.2mol Ʒ����Һ����ɫ b Cl2+SO2+2H2O = 2HCl+H2SO4
Mn2+ +Cl����+2H2O 0.2mol Ʒ����Һ����ɫ b Cl2+SO2+2H2O = 2HCl+H2SO4
��������
Aװ�����������ƺ�Ũ���ᷴӦ�Ʊ�����������Ʒ����Һ��������Ư���ԣ�E����Ũ����Ͷ������̼����Ʊ���������ͨ��Ʒ����Һ����������Ư���ԣ�����������Һ��Ϊβ������װ�ã����ն���������Ͷ�������
(1)�������ƺ�Ũ���ᷴӦ���������ƣ�ˮ����������ϡ������ˮ�ĺ����϶࣬���ɵĶ�������������ˮ����������ɵĶ���������٣�
(2)ʵ�����Ʊ����������Ļ�ѧ��ӦΪMnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O�����ݻ�ѧ����ʽ��д���ӷ���ʽ�����ݻ��ϼ۵ı仯����ת�Ƶĵ�����Ŀ��
MnCl2+Cl2��+2H2O�����ݻ�ѧ����ʽ��д���ӷ���ʽ�����ݻ��ϼ۵ı仯����ת�Ƶĵ�����Ŀ��
(3)SO2�ʹ����������Ư���ԣ�
(4)�������н�ǿ�������ԣ�����������н�ǿ�Ļ�ԭ�ԣ���ˮ��Һ�����߷�����ӦCl2+SO2+2H2O�T2HCl+H2SO4��
(1)Ũ������Na2SO3��Ӧ����ѧ����ʽ��Na2SO3+H2SO4(Ũ)= Na2SO4+H2O+SO2�� ����ΪSO2��ˮ����һ�����ܽ�ȣ�������ϡ���ᣬ����һ����SO2�ܽ�����Һ�С���SO2��Ũ���������ܣ�����ѡ��Ũ���ᣬ����Ũ����Ũ�ȸߣ�Ч�ʸߣ�
(2)ʵ������װ��E�Ʊ����������ӷ���ʽ��MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O��1mol�������̲��뷴Ӧ��ת��2mol���ӣ����ӷ�ӦΪMnO2 +4H+ +2Cl-
Mn2++Cl2��+2H2O��1mol�������̲��뷴Ӧ��ת��2mol���ӣ����ӷ�ӦΪMnO2 +4H+ +2Cl-![]() Mn2+ +Cl2��+2H2O�����뷴Ӧ�Ķ������̵����ʵ���n=
Mn2+ +Cl2��+2H2O�����뷴Ӧ�Ķ������̵����ʵ���n=![]() =
=![]() =0.1mol����ת�Ƶĵ��ӵ����ʵ���Ϊ��0.2mol��
=0.1mol����ת�Ƶĵ��ӵ����ʵ���Ϊ��0.2mol��
(3)�����������Ư���ԣ���ʹƷ����Һ��ɫ����B������Ʒ����Һ��ɫ��������������ˮ���ɴ�����Ҳ����Ư���ԣ���D��Ʒ��Ҳ��ɫ��
(4)�������������������ͨ��Ʒ����Һ�У����߳�ַ�Ӧ�������ﶼ���߱�Ư���ԣ���Ӧ�Ļ�ѧ����ʽ��SO+Cl+2HO=HSO+2HCl��

 ��У����ϵ�д�
��У����ϵ�д�