题目内容
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
A.含16g氧原子的二氧化硅晶体中含有的σ键数目为 NA
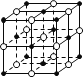
B.58.5 g NaCl晶体中含有0.25NA个上图所示的结构单元
C.常温常压下,5gD2O含有的质子数、电子数、中子数均为2.5NA
D.标准状况下,22.4L乙烷中含有极性键的数目为6NA
【答案】A
【解析】
A. 1molSiO2晶体中含有4molσ键,含16 g氧原子的二氧化硅晶体的物质的量为0.5mol,含有的σ键数目为2NA,A错误;
B. 58.5 g NaCl的物质的量是1mol,根据均摊法,假设小黑球为钠离子,空心球为氯离子,则NaCl晶体的晶胞含有![]() =4个钠离子,
=4个钠离子,![]() =4个氯离子,所以58.5 gNaCl晶体中含有0.25NA个图示的结构单元,B正确;
=4个氯离子,所以58.5 gNaCl晶体中含有0.25NA个图示的结构单元,B正确;
C. 5gD2O的物质的量是![]() =0.25mol ,1个D2O分子中含有10个质子、10个电子、10个中子,所以5g D2O含有的质子数、电子数、中子数均为2.5NA,C正确;
=0.25mol ,1个D2O分子中含有10个质子、10个电子、10个中子,所以5g D2O含有的质子数、电子数、中子数均为2.5NA,C正确;
D. 标准状况下,22.4L乙烷物质的量为1mol,根据乙烷的结构式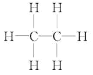 ,每个分子中含有6个极性键,一个非极性键,则22.4L乙烷中含有极性键的数目为6NA,D正确;
,每个分子中含有6个极性键,一个非极性键,则22.4L乙烷中含有极性键的数目为6NA,D正确;
答案选A。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】向容积均为0.5L的甲、乙、丙三个密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
容器 | 甲 | 乙 | 丙 |
温度/℃ | T1 | T2 | T2 |
反应物起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 3.0molA 1.0molB |
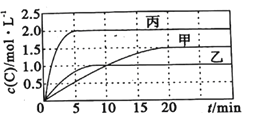
则: (1)该反应为____________(填 “放热反应”或“吸热反应”)
(2)丙容器中前5分钟的A的反应速率为__________
(3)该可逆反应达到平衡后,为在提高反应速率的同时提高B的转化率,可采取的措施有___________(填标号)。
a.按体积比1:1再充入A和B b.改用高效催化剂 c.升高温度 d.增加A的浓度 e. 增加C的浓度
(4)乙容器中的化学平衡常数为_____________