题目内容
(12分,每空2分)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NaOH和NH3。请回答下列问题:
(1)Na3N的电子式是_______;该化合物是由______键形成的_____(填“离子”或“共价”)化合物。
(2)Na3N与盐酸反应生成__________种盐,对应的反应方程式是 。
(3)比较Na3N中两种微粒的半径:r(Na+)__________r(N3-)(填“>”“=”“<”符号)。
(1)Na3N的电子式是_______;该化合物是由______键形成的_____(填“离子”或“共价”)化合物。
(2)Na3N与盐酸反应生成__________种盐,对应的反应方程式是 。
(3)比较Na3N中两种微粒的半径:r(Na+)__________r(N3-)(填“>”“=”“<”符号)。
(1) ;离子 离子;(2) 两 Na3N+4HCl==3NaCl+NH4Cl; (3)<
;离子 离子;(2) 两 Na3N+4HCl==3NaCl+NH4Cl; (3)<
 ;离子 离子;(2) 两 Na3N+4HCl==3NaCl+NH4Cl; (3)<
;离子 离子;(2) 两 Na3N+4HCl==3NaCl+NH4Cl; (3)<试题分析:(1)Na3N是离子化合物;在Na与N原子之间通过离子键结合。Na3N的电子式是
 。(2)Na3N与盐酸反应的方程式Na3N+4HCl=3NaCl+ NH4Cl.因此生成2种盐。(3)Na+、N3-的核外都是2、8的电子层结构。对于电子层结构相同的微粒来说,核电荷数越大,离子的半径就越小。因此在Na3N中两种微粒的半径:r(Na+)<r(N3-)。
。(2)Na3N与盐酸反应的方程式Na3N+4HCl=3NaCl+ NH4Cl.因此生成2种盐。(3)Na+、N3-的核外都是2、8的电子层结构。对于电子层结构相同的微粒来说,核电荷数越大,离子的半径就越小。因此在Na3N中两种微粒的半径:r(Na+)<r(N3-)。
练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
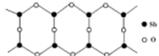
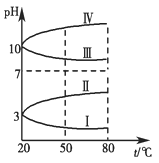

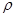 g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。
g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。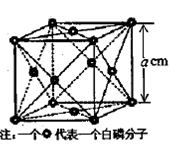
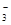 的空间构型为________,写出与NO
的空间构型为________,写出与NO
