题目内容
(12分)【化学——物质结构与性质】
氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是 。
(2)NH3在水中的溶解度比PH3大得多,其原因是 。向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。该晶体中含有的化学键除普通的共价键外,还有 和 。
(3)PCl3分子中,Cl-P-Cl键的键角____ 109o28’(填“>”“<”或“=”)。
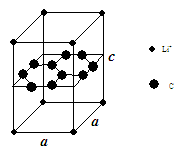
(4)白磷(P4)是磷的一种单质,它属于分子晶体,其晶胞结构如图。己知该晶体的密度为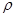 g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。
g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。
氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是 。
| A.N2可用于填充霓虹灯。其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量 |
| B.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na |
| C.基态As原子中,电子占据的最高能级为4d |
| D.Bi原子中最外层有5个能量相同的电子 |
(3)PCl3分子中,Cl-P-Cl键的键角____ 109o28’(填“>”“<”或“=”)。
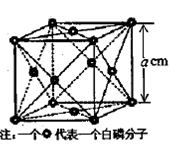
(4)白磷(P4)是磷的一种单质,它属于分子晶体,其晶胞结构如图。己知该晶体的密度为
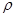 g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。
g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。
(12分)
(1)b(2分)
(2)NH3分子与水分子之间能够形成氢键(2分) 离子键(2分) 配位键(2分)
(3) < (2分)
(4)496/(ρa3) (2分)
(1)b(2分)
(2)NH3分子与水分子之间能够形成氢键(2分) 离子键(2分) 配位键(2分)
(3) < (2分)
(4)496/(ρa3) (2分)
试题分析:(1)a、以光的形式释放能量时,电子从能量较高的轨道跃迁到能量较低的轨道,错误;b、P为第VA族元素,3p轨道排布3个电子,为半充满状态,更稳定,第一电离能较大,所以P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na,正确;c、基态As原子中,电子占据的最高能级为4p,错误;d、Bi为第六周期第VA族元素,原子中最外层有3个能量相同的电子,错误。
(2)N、O原子半径小而电负性大,NH3分子与水分子之间能够形成氢键,PH3分子与水分子之间不能形成氢键,所以NH3在水中的溶解度比PH3大得多;[Cu(NH3)4]2+与SO42-之间形成了离子键;Cu2+与NH3之间形成了配位键。
(3)PCl3中P原子杂化方式为sp3杂化,分子构型为三角锥型,P原子含有一对孤对电子,对成键电子有较强的排斥作用,所以Cl-P-Cl键的键角<109o28’。
(4)根据晶胞示意图,P4分子位于晶胞的8个顶点和6个面的面心,则1个晶胞含P4分子:8×1/8+6×1/2=4,以1个晶胞为研究对象,ρ=4×124÷NA÷a3,解得NA=496/(ρa3)。

练习册系列答案
相关题目