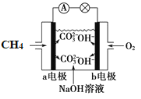
题目内容
【题目】钛及其化合物应用广泛。
(1)(钛元素基态原子核外最外层电子的自旋状态___(填“相同”或“相反”)。
(2)已知一定条件下TiO2与TiCl4之间可以相互转化:TiO2![]() TiCl4。
TiCl4。
①Ti、Cl、O三种元素电负性由大到小的顺序为___。
②COCl2的分子构型为___,键角大小比较∠Cl—C—O___∠C1—C—Cl(填“>”或“<”),σ键和π键数目之比为___。
③已知室温下TiCl4为无色易溶于乙醇的液体,则TiCl4的晶体类型为___。
(3)配合物[TiCl(H2O)5]Cl2·H2O中,中心离子的配位数是___,向1mol该配合物中加入足量AgNO3溶液,可以得到___molAgCl沉淀。
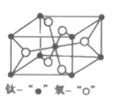
(4)金红石型TiO2的晶胞(α=β=γ=90o)如图所示:TiO2晶体中O原子的配位数是___,其晶胞参数为:a=b=459pm,c=295pm,该晶体密度为___g/cm3(列出计算式)。
【答案】相反 O>Cl>Ti 平面三角形 > 3 分子晶体 6 2 3 ![]()
【解析】
(1)钛为22号元素,根据价电子排布式分析;
(2)①元素原子的得电子能力越强,则电负性越大;
②根据1个单键是1个σ键,1个双鍵中含有1个σ键,1个π键以及COCl2分子的结构式来解答;
③通常低熔点、易溶于有机溶剂的晶体属于分子晶体;
(3)配合物[TiCl(H2O)3]Cl2·H2O中,配位体是内界的1个Cl-和5个H2O;
(4)根据均摊法结合晶胞数据分析解答。
(1)钛为22号元素,基态电子排布式为:[Ar]3d24s2,则基态钛原子的价电子排布式为3d24s2,原子核外最外层电子数为2,自旋状态相反;
(2)①元素原子的得电子能力越强,则电负性越大,所以O>Cl>Ti;
②COCl2的结构为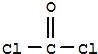 ,中心原子C上含有3个σ键,没有孤电子对,属于sp2杂化,其分子构型为平面三角形;
,中心原子C上含有3个σ键,没有孤电子对,属于sp2杂化,其分子构型为平面三角形;
在COCl2分子中, C原子为sp2杂化,虽然等性sp2杂化的键角是120°。但由于C原子与O原子间以双键C=O结合,该双键对C-Cl键的斥力要更大些。所以,∠O-C-Cl键角要大于∠Cl-C-Cl键角;答案为>;
COCl2分子中有1个C=O键和2个C-Cl键,所以COCl2分子中σ键的数目为3,π键数目为1,个数之比为3:1;
③通常低熔点、易溶于有机溶剂的晶体属于分子晶体,则TiCl4的晶体类型为分子晶体;
(3)配合物[TiCl(H2O)5]Cl2·H2O中,配位体是内界的1个Cl-和5个H2O,中心离子的配位数是6,作为配体的Cl-难以电离出来与Ag+发生反应,故向1mol该配合物中加入足量AgNO3溶液,可以得到2molAgCl沉淀;
(4)根据均摊法,晶胞中有2个原子和4个O原子,因此晶胞质量=![]() ,晶胞体积=459
,晶胞体积=459![]() ,因此,晶胞密度=
,因此,晶胞密度=![]() 。
。