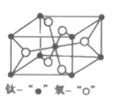
��Ŀ����
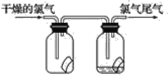
����Ŀ����1����ͼ��ʾ������������ͨ��ʢ�и�����ɫ�����Ĺ��ƿ��ʢ��ʪ����ɫ�����Ĺ��ƿ���ɹ۲쵽��������_______��
��2��Ϊ��ֹ����β����Ⱦ������ʵ����ͨ����________��Һ���ն����������ԭ����______________________(�û�ѧ����ʽ��ʾ)����ҵ�ϳ������۵�ʯ�������չ�ҵ����β���Ƶ�Ư�ۣ�Ư�۵���Ч�ɷ���________________(�ѧʽ)��Ư������ˮ���ܿ����е�CO2���ã�������Ư�ס�ɱ�����õĴ����ᣬ��ѧ����ʽΪ_____________________������¶���ڿ����е�Ư�ۣ���ϡ����������������________(����ĸ����ͬ)��
A��O2B��Cl2 C��CO2D��HClO
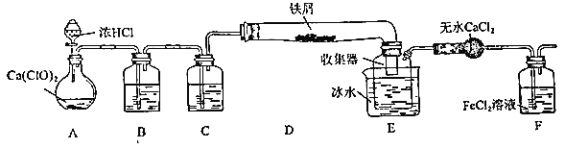
��3��һ����������й©�ͱ�ը�¹ʣ���ΧȺ��Ӧ������ɢ�����������뱬ը�ֳ�ʱ�������ý���һ��Ũ��ij����ˮ��Һ��ë����ס���ӣ������˲��õĸ�������________��
A��NaOH B��NaCl
C��KCl D��Na2CO3
���𰸡��������ɫ��������ɫ��ʪ�����ɫ������ɫ NaOH(����������) Cl2��2NaOH===NaCl��NaClO��H2O Ca(ClO)2 Ca(ClO)2��CO2��H2O===CaCO3����2HClO C D
��������
��1��������Ư���ԣ�������ˮ��Ӧ���ɵĴ��������Ư���ԣ�
��2����������������������Һ��Ӧ������β����ʯ�������չ�ҵ����β���Ƶ�Ư�������Ȼ��ơ�������ƣ���Ӧ�Ļ�ѧ����ʽΪ��2Cl2+2Ca��OH��2=CaCl2 +Ca��ClO��2 +2H2O���������Ca��ClO��2�ܿ����е�CO2��ˮ���ã���������Ư�ס�ɱ�����õĴ������һ�ֳ�������Ӧ�Ļ�ѧ����ʽΪ��Ca��ClO��2+CO2+H2O�TCaCO3��+2HClO��̼��ƺ����ᷴӦ���ɶ�����̼�����Գ���¶���ڿ����е�Ư�ۣ���ϡ���������������Ƕ�����̼��
��3������NaOH��ʴ��ǿ������ü�������Na2CO3����ʡ�
(1)���������������Ư���ԣ�������ˮ��Ӧ���ɵĴ�����ž���Ư���ԣ��������ɫ��������ɫ��ʪ�����ɫ������ɫ���������ɫ��������ɫ��ʪ�����ɫ������ɫ��
(2)Ϊ�˷�ֹ����β����Ⱦ����������NaOH��Һ���գ��÷�Ӧ�Ļ�ѧ����ʽΪCl2+2NaOH=NaCl+NaClO+H2O�����ӷ�ӦΪCl2+2OH��=Cl��+ClO��+H2O��Ư������ˮ���ܿ����е�CO2���ã�������Ư�ס�ɱ�����õĴ����ᣬ��ѧ����ʽΪCa(ClO)2��CO2��H2O=CaCO3����2HClO��Ư�۳���¶���ڿ����л��������CaCO3����ϡ��������CO2���壻
�ʴ�Ϊ��NaOH��Cl2+2NaOH=NaCl+NaClO+H2O��Ca(ClO)2 ��Ca(ClO)2��CO2��H2O=CaCO3����2HClO��C��
��3�������ܹ���Ӧ������NaOH��ʴ��ǿ������ü�������Na2CO3����ʣ���ѡD��

 ��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�����Ŀ����1��ʵ���ã�5gҺ̬�״�(CH3OH)�������г��ȼ�����ɶ�����̼�����Һ̬ˮʱ�ͷų�113��5kJ����������д���״�ȼ�յ��Ȼ�ѧ����ʽ____________________________________��
��2����֪��ӦN2+3H2![]() 2NH3 ��H=akJ/mol���Ը����±������м������ݹ���a����ֵΪ______��
2NH3 ��H=akJ/mol���Ը����±������м������ݹ���a����ֵΪ______��
��ѧ�� | H-H | N-H | N��N |
����kJ/mol | 436 | 391 | 945 |
��3�����ݸ�˹���ɿ��Զ�ijЩ����ͨ��ʵ��ֱ�Ӳⶨ�Ļ�ѧ��Ӧ���ʱ�������㡣
��֪��C(s��ʯī)+O2(g)=CO2(g) ��Hl=-393. 5kJ/mol
2H2(g)+O2(g)=2H2O(l) ��H2=-571.6kJ/mol
2C2H2(g) +5O2(g) =4CO2(g) +2H2O(1) ��H3=-2599kJ/mol
���Ƹ�˹���ɣ�����298Kʱ��C(s,ʯī)��H2(g)����1mol C2H2(g)��Ӧ�Ȼ�ѧ����ʽ:__________��