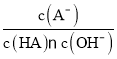题目内容
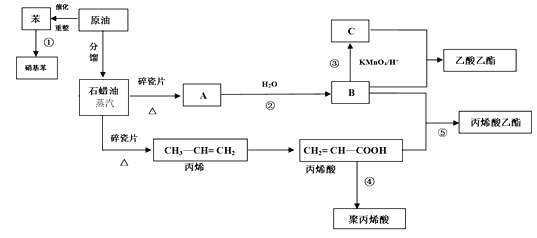
【题目】处理烟气中的SO2,可以采用碱吸-电解法,其流程如图:模拟过程Ⅱ如图,下列推断正确的是( )
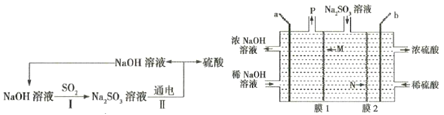
A.膜1为阳离子交换膜,膜2为阴离子交换膜
B.SO2是含有极性键的极性分子
C.a极的电极反应式为2H2O-4e-=4H++O2↑
D.若收集22.4 L的P(标准状况下),则有2 mol N离子移向右室
【答案】AB
【解析】
A.b电极上稀硫酸转化为浓硫酸,过程中SO42-的量增大,则是由SO32-转化得到,发生反应SO32--2e-+H2O=SO42-+2H+,则膜2应为阴离子交换膜;a电极上稀NaOH溶液转化为浓NaOH溶液,过程中OH-浓度增大,则发生电极反应2H2O+2e-=2OH-+H2↑,膜1应为阳离子交换膜,A正确;
B.SO2分子中的S=O键是极性共价键,由于分子中正、负电荷重心不重合,因此SO2属于极性分子,B正确;
C.a电极上稀NaOH溶液转化为浓NaOH溶液,过程中OH-浓度增大,且反应有气体产生,则应发生的电极反应式为:2H2O+2e-=2OH-+H2↑,C错误;
D.a电极发生电极反应为:2H2O+2e-=2OH-+H2↑,若收集22.4 LP(标准状况下),即收集标况下H2的的物质的量n(H2)=![]() =1 mol,根据电极反应式可知转移电子数为2 mol,b电极发生反应:SO32--2e-+H2O=SO42-+2H+,根据同一闭合回路中电子转移数目相等,可知有1 mol SO32-通过膜2进入右室,D错误;
=1 mol,根据电极反应式可知转移电子数为2 mol,b电极发生反应:SO32--2e-+H2O=SO42-+2H+,根据同一闭合回路中电子转移数目相等,可知有1 mol SO32-通过膜2进入右室,D错误;
故合理选项是AB。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
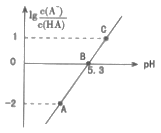
新黄冈兵法密卷系列答案【题目】室温下,将一定浓度的一元酸HA溶液和一定浓度的NaOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度(mol/L) | 反应后溶液的pH | |
|
| ||
① | 0.1 | 0.1 | 9 |
② |
| 0.2 | 7 |
下列判断不正确的是( )
A.实验①反应的溶液中:![]()
B.实验①反应的溶液中:![]()
C.实验②反应的溶液中:![]()
D.实验②反应的溶液中:![]()