题目内容
8.下列热化学方程式或离子方程式中,正确的是( )| A. | 将铝表面的氧化物溶于NaOH溶液:Al2O3+2OH-+3H2O═2Al(OH)3↓ | |
| B. | 碳酸氢钠的水解:HCO3-+H2O?H3O++CO32- | |
| C. | 500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g).放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6KJ/mol | |
| D. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(1)△H=-890.3kJ•mol-1 |
分析 A.不符合反应的客观事实;
B.碳酸氢钠的水解生成碳酸和氢氧化钠;
C.工业合成氨反应为可逆反应,不能进行到底;
D.燃烧热指的是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,注意生成的水应为液态.
解答 解:A.铝表面的氧化物溶于NaOH生成偏铝酸钠,化学方程式:Al2O3+2OH-═2AlO2-↓+H2O,故A错误;
B.碳酸氢钠的水解,离子方程式:HCO3-+H2O?OH-+H2CO3,故B错误;
C.0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热不是38.6kJ,则热化学反应方程式中的反应热数值错误,故C错误;
D.甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(1)△H=-890.3kJ•mol-1,故D正确;
故选:D.
点评 本题考查了化学方程式、离子方程式、热化学方程式的书写,侧重考查学生对基础知识的掌握,注意对燃烧热的概念的理解,题目难度不大.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
16.在生产和生活中,人们广泛利用着化学反应释放的能量.下列说法正确的是( )
| A. | 有能量变化的都是化学变化 | |
| B. | 物质发生化学变化并不一定都伴随着能量变化 | |
| C. | 用实验方法和理论方法研究反应热的化学称为热化学 | |
| D. | 任何反应中的能量变化都表现为热量变化 |
13.下列反应不属于水解反应或水解方程式不正确的是 ( )
①HCl+H2O═H3O++Cl- ②ZnCl2+2H2O═Zn(OH)2+2HCl ③Na2CO3+2H2O?H2CO3+2NaOH ④Al2(CO3)3+6H2O?2Al(OH)3↓+3H2CO3.
①HCl+H2O═H3O++Cl- ②ZnCl2+2H2O═Zn(OH)2+2HCl ③Na2CO3+2H2O?H2CO3+2NaOH ④Al2(CO3)3+6H2O?2Al(OH)3↓+3H2CO3.
| A. | ①② | B. | ③④ | C. | ①②④ | D. | 全部 |
17.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时应使温度计水银球与蒸馏烧瓶支管口平齐 | |
| C. | 蒸发时,待蒸发皿中没有水了再停止加热 | |
| D. | 称量氢氧化钠时,应先将小烧杯放在左盘称量,再将药品加入到小烧杯中称量 |

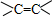 、醛基-CHO、羧基-COOH、-COOR酯基.
、醛基-CHO、羧基-COOH、-COOR酯基.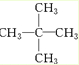 ,名称为2,2-二甲基丙烷.
,名称为2,2-二甲基丙烷.