题目内容
18.(1)写出下列基团(或官能团)的名称或结构简式:-CH2CH3乙基、-OH羟基、碳碳双键
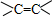 、醛基-CHO、羧基-COOH、-COOR酯基.
、醛基-CHO、羧基-COOH、-COOR酯基.(2)某烷烃的分子量为 72,跟氯气反应生成的一氯代物只有一种,该烷烃的结构简式为
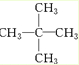 ,名称为2,2-二甲基丙烷.
,名称为2,2-二甲基丙烷.
分析 (1)乙基为:-CH2CH3;羟基为:-OH;碳碳双键为: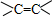 ;醛基为-CHO;羧基为-COOH,-COOR为酯基,
;醛基为-CHO;羧基为-COOH,-COOR为酯基,
(2)烷烃的通式为CnH2n+2,根据相对分子质量可知12n+2n+2=72,则n=5,该烷烃的分子式应为C5H12,跟氯气反应生成的一氯代物只有一种,说明结构对称,分子中只含有一种H,据此解答该题.
解答 解:(1)-CH2CH3为乙基;-OH为羟基;碳碳双键结构简式为: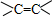 ;-CHO为醛基,羧基的结构简式是:-COOH,酯基的结构简式为:-COOR,
;-CHO为醛基,羧基的结构简式是:-COOH,酯基的结构简式为:-COOR,
故答案为:乙基;羟基;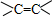 ;-CHO;-COOH;酯基;
;-CHO;-COOH;酯基;
(2)烷烃的通式CnH2n+2,该烷烃的相对分子质量为72,
所以有:12n+2n+2=72,即14n=70,
解得n=5,即分子式为C5H12.含5个碳原子的烷烃的一氯取代物只有一种,说明烃分子中12个氢原子的位置均是等效的,分子结构对称,结构简式应为 ,为2,2-二甲基丙烷;
,为2,2-二甲基丙烷;
故答案为: ;2,2-二甲基丙烷.
;2,2-二甲基丙烷.
点评 本题考查了常见有机物的官能团、有机物结构简式的书写,掌握常见有机物的结构与性质,明确有机物的命名原则是解题关键,题目难度不大.

练习册系列答案
相关题目
8.下列热化学方程式或离子方程式中,正确的是( )
| A. | 将铝表面的氧化物溶于NaOH溶液:Al2O3+2OH-+3H2O═2Al(OH)3↓ | |
| B. | 碳酸氢钠的水解:HCO3-+H2O?H3O++CO32- | |
| C. | 500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g).放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6KJ/mol | |
| D. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(1)△H=-890.3kJ•mol-1 |
13.下表列出了①~⑥六种元素在元素周期表中的位置.
请回答下列问题:
(1)③的元素符号是Mg.
(2)②、③、④三种元素相比较,金属性最强的是Na (填写元素符号);
(3)元素⑤和⑥的氢化物中,稳定性较强的是HF(填氢化物的分子式);
(4)④的最高价氧化物对应的水化物的化学式为Al(OH)3;
(5)画出元素③的原子结构示意图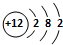 ;
;
(6)元素③的单质与盐酸反应的离子方程式为Mg+2H+=Mg2++H2↑;
(7)元素②形成的盐如:碳酸钠.当碳酸钠中含有碳酸氢钠杂质时,除去此杂质的简单方法是加热(填“萃取”或“加热”或“蒸馏”).
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ⑤ | ||||||
| 3 | ② | ③ | ④ | ⑥ |
(1)③的元素符号是Mg.
(2)②、③、④三种元素相比较,金属性最强的是Na (填写元素符号);
(3)元素⑤和⑥的氢化物中,稳定性较强的是HF(填氢化物的分子式);
(4)④的最高价氧化物对应的水化物的化学式为Al(OH)3;
(5)画出元素③的原子结构示意图
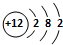 ;
;(6)元素③的单质与盐酸反应的离子方程式为Mg+2H+=Mg2++H2↑;
(7)元素②形成的盐如:碳酸钠.当碳酸钠中含有碳酸氢钠杂质时,除去此杂质的简单方法是加热(填“萃取”或“加热”或“蒸馏”).
10.下列叙述正确的是( )
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子的过程叫电离 | |
| B. | 凡溶于水后能电离出氢离子的化合物都是酸 | |
| C. | 二氧化碳溶于水后能导电,故二氧化碳属于电解质 | |
| D. | 硫酸钡难溶于水,但溶解部分完全电离,故硫酸钡是强电解质 |