题目内容
18.下列有关原电池的判断错误的是( )①所有金属都能作电极
②有活泼性不同的两种金属电极、有电解质溶液、导线就一定能构成原电池,对外放电
③原电池放电实现化学能转化为电能
④以铁、铜为电极,在稀硫酸溶液中构成原电池,负极反应式为Fe-3e-═Fe3+.
| A. | ①② | B. | ①③ | C. | ①②④ | D. | ①②③④ |
分析 ①活泼的金属易与水反应,不能作电极;
②根据原电池的构成条件分析;
③原电池是将化学能转化为电能的装置;
④以铁、铜为电极,在稀硫酸溶液中构成原电池,负极反应式为Fe-2e-═Fe2+.
解答 解:①活泼的金属易与水反应,不能作电极,故错误;
③原电池的构成条件①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,若有活泼性不同的两种金属电极、有电解质溶液、导线,如果不能自发发生氧化还原反应,则不能形成原电池,故错误;
③原电池反应中能自发的进行氧化还原反应,是将化学能转化为电能的装置,故正确;
④以铁、铜为电极,在稀硫酸溶液中构成原电池,负极反应式为Fe-2e-═Fe2+,故错误;
故选C.
点评 本题考查的内容是高考中的常见考点,属于基础性试题的考查,难度不大,明确原电池的工作原理、构成条件是答题的关键.

练习册系列答案
相关题目
8.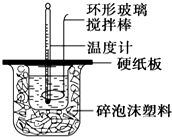 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
(1)本实验中用稍过量的NaOH的原因是保证盐酸完全被中和.在大小烧杯中填充泡沫塑料的作用是保温隔热,防止热量散失.
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见下表).
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容为:c=4.18×10-3kJ/(g•℃),则写出该反应的热化学方程式H+(aq)+OH-(aq)=H2O(l)△H=-56.0kJ/mol(△H值保留到小数点后1位).
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的△H偏大(填“偏大”、“偏小”或“不变”),其原因是醋酸是弱酸,反应时需要吸收热量用于醋酸的电离,所以,测得的中和反应的反应热数值会偏小,该反应为放热反应,△H则偏大.
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此操作步骤,则测得的中和热△H会偏大(填“偏大”、“偏小”或“不变”).
 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:(1)本实验中用稍过量的NaOH的原因是保证盐酸完全被中和.在大小烧杯中填充泡沫塑料的作用是保温隔热,防止热量散失.
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见下表).
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的△H偏大(填“偏大”、“偏小”或“不变”),其原因是醋酸是弱酸,反应时需要吸收热量用于醋酸的电离,所以,测得的中和反应的反应热数值会偏小,该反应为放热反应,△H则偏大.
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此操作步骤,则测得的中和热△H会偏大(填“偏大”、“偏小”或“不变”).
9.下列排列顺序不正确的是( )
| A. | 熔点:Br2>Cl2>F2 | B. | 氧化性:Cl2>Br2>I2 | ||
| C. | 酸性:HClO4>HBrO4>HIO4 | D. | 稳定性:HI>HBr>HCl>HF |
6.关于元素周期表,下列叙述中不正确的是( )
| A. | 过渡元素全部是副族元素 | |
| B. | 周期表中的周期分为:短周期、长周期 | |
| C. | 周期表中的族分为:主族、副族、0族和VIII族 | |
| D. | 由短周期元素和长周期元素共同组成的族称为主族(除0族外) |
13.下列有机化合物既可以通过取代反应,也可以通过加成反应或水解反应制得的是( )
| A. | 乙烷 | B. | 乙酸乙酯 | C. | 乙醇 | D. | 葡萄糖 |
3.设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol甲基所含有的电子数为10NA | |
| B. | 标准状况下,11.2L氯仿(CHCl3)中含有C-Cl键的数目为1.5NA | |
| C. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA | |
| D. | 6.0g冰醋酸与4.6g乙醇反应生成乙酸乙酯的分子数为0.1 NA |
10.在某溶液中加入AgNO3溶液,再加入稀硝酸,有白色沉淀出现,则该溶液 ( )
| A. | 必定是可溶性氯化物 | B. | 可能是可溶性碳酸盐 | ||
| C. | 可能含有Cl- | D. | 必定是氯水 |

 ,固体A的化学式为Al(OH)3;
,固体A的化学式为Al(OH)3; .
.