题目内容
15.下列关于化学键的说法正确的是( )| A. | 化学键的类型由元素的类别决定 | |
| B. | 不同种元素组成的多原子分子里的化学键一定是极性键 | |
| C. | 阴、阳离子相互反应形成的化学键称为离子键 | |
| D. | 熔融态下能导电的化合物中一定含离子键 |
分析 A.化学键的类型由作用力决定;
B.不同种元素组成的多原子分子里可存在极性键、非极性键;
C.离子之间的作用力为离子键;
D.熔融态下能导电的化合物,其构成微粒为离子.
解答 解:A.化学键的类型由作用力决定,由离子之间的静电作用力形成的为离子键,由共用电子对的静电作用力形成的为共价键,不能由元素决定,如铵盐均为非金属元素为离子化合物,而氯化铝中含金属元素为共价化合物,故A错误;
B.不同种元素组成的多原子分子里可存在极性键、非极性键,如H-O-O-H分子中含极性键、非极性键,故B错误;
C.化学键包含离子键和共价键,阴、阳离子相互反应形成的化学键称为离子键,故C正确;
D.熔融态下能导电的化合物,其构成微粒为离子,则化合物中一定含离子键,故D正确;
故选D.
点评 本题考查化学键,为高频考点,把握化学键的形成、物质中的化学键等为解答的关键,侧重分析与应用的考查,注意利用实例分析解答,题目难度不大.

练习册系列答案
相关题目
12.下列化学用语的书写,正确的是( )
| A. | 氯原子的结构示意图: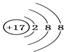 | |
| B. | 6个质子8个中子的碳元素的核素符号:12C | |
| C. | 氯化镁的电子式: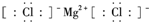 | |
| D. | 用电子式表示氯化氢的形成过程: |
13.已知H2(g)+Br2(g)=2HBr(g);△H=A KJ/mol,其它的相关数据如下表:
则表中a为( )
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | B | a | C |
| A. | A-B+C | B. | 2C-A-B | C. | C-A-B | D. | A-B+2C |
20.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| C. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| D. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 |
7.甲烷分子是以碳原子为中心的正四面体结构而不是正方形的平面结构,其理由是( )
| A. | CHCl3只有一种结构 | |
| B. | CH2Cl2只有一种结构 | |
| C. | CH4是非极性分子 | |
| D. | CH4的四个价键的键长和键能都相等 |
5.类推是学习和研究化学的重要思维方法.下列类推结论正确的是( )
| A. | 向Ba(NO3)2溶液中通入CO2不产生白色沉淀,则通入SO2也不产生白色沉淀 | |
| B. | 电负性:C<N<O,则第一电离能:C<N<O | |
| C. | 乙醛能被新制Cu(OH)2氧化,则乙醛也能被溴水氧化 | |
| D. | HBr的沸点小于HI的沸点,则HBr的稳定性小于HI的稳定性 |

 ;下列对于乙的描述正确的是d.
;下列对于乙的描述正确的是d.