题目内容
【题目】电化学在生产生活中都具有重要的作用和意义:
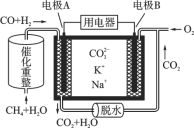
(1)图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图:该电池的负极反应式为:_________,若串联该燃料电池来电解硫酸钠溶液,消耗4.6g二甲醚后总共可在电解池两极收集到13.44L(标况)气体,该套装置的能量利用率为___________.(保留三位有效数字)

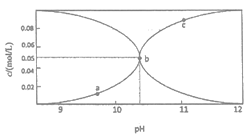
(2)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为_______。电解后,____室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。

(3)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,答下列问题:
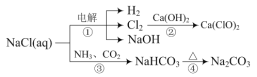
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:电解时发生反应的化学方程式为______。溶液X中大量存在的阴离子有___。

(4)测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入 3 mL稀硫酸. 将一定量的混合气体通入混合溶液中充分吸收, 发生反应: 2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
Ⅱ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),以淀粉溶液为指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。
①滴定至终点的现象是______, 测得混合气中ClO2的质量为______ g。
②测定混合气中ClO2的含量的操作中可能使测定结果偏低的是____(填字母)。
A.滴定管未润洗就直接注入硫代硫酸钠标准液
B.锥形瓶用蒸馏水洗净后没有干燥
C.滴定管读取标准液体积时,开始仰视读数,滴定结束时俯视读数
【答案】CH3OCH3-12e-+3H2O=2CO2+12H+ 66.7% 2H2O-4e-=4H++O2↑或4OH--4e- =O2↑+2H2O a NH4Cl+2HCl![]() 3H2↑+NCl3 Cl-、OH- 溶液由蓝色变为无色,且半分钟内溶液颜色不再改变 0.02700 C
3H2↑+NCl3 Cl-、OH- 溶液由蓝色变为无色,且半分钟内溶液颜色不再改变 0.02700 C
【解析】
(1)燃料电池中通入燃料的一极为负极,负极上二甲醚失电子生成二氧化碳和氢离子,则负极的电极方程式为:CH3OCH3-12e-+3H2O=2CO2+12H+;电解硫酸钠溶液两级生成氢气和氧气,若两极收集到13.44L(标况)气体,生成气体的物质的量为![]() =0.6mol,生成的氢气和氧气的体积比为2:1,则阴极产生0.4mol氢气,阳极产生0.2mol氧气,电路中转移电子为0.2mol×4=0.8mol,由燃料电池电极反应CH3OCH3-12e-+3H2O=2CO2+12H+可知,消耗4.6g二甲醚转移电子为
=0.6mol,生成的氢气和氧气的体积比为2:1,则阴极产生0.4mol氢气,阳极产生0.2mol氧气,电路中转移电子为0.2mol×4=0.8mol,由燃料电池电极反应CH3OCH3-12e-+3H2O=2CO2+12H+可知,消耗4.6g二甲醚转移电子为![]() =1.2mol,所以该套装置的能量利用率为
=1.2mol,所以该套装置的能量利用率为![]() ×100%=66.7%,故答案为:CH3OCH3-12e-+3H2O=2CO2+12H+,66.7%。
×100%=66.7%,故答案为:CH3OCH3-12e-+3H2O=2CO2+12H+,66.7%。
(2)阳极发生失去电子的氧化反应,阳极区是稀硫酸,氢氧根放电,则电极方程式为:2H2O-4e-=4H++O2↑或4OH--4e- =O2↑+2H2O,阳极区氢离子增大,通过阳离子交换膜进入a室与亚硫酸钠结合生成亚硫酸氢钠,阴极是氢离子放电,氢氧根浓度增大,与亚硫酸氢钠反应生成亚硫酸钠,所以电解后a室总亚硫酸氢钠的浓度增大,故答案为:2H2O-4e-=4H++O2↑或4OH--4e- =O2↑+2H2O,a。
(3)由电解产物有H2和NCl3,可得出电解方程式为:NH4Cl+2HCl![]() 3H2↑+NCl3,向反应后的NCl3的溶液中加入NaClO2溶液,会发生氧化还原反应,产生ClO2、NH3和溶液X,根据反应NCl3+6NaClO2+3H2O=6ClO2↑+NH3↑+3NaCl+3NaOH,故溶液X中大量存在的阴离子有Cl-、OH-,故答案为:NH4Cl+2HCl
3H2↑+NCl3,向反应后的NCl3的溶液中加入NaClO2溶液,会发生氧化还原反应,产生ClO2、NH3和溶液X,根据反应NCl3+6NaClO2+3H2O=6ClO2↑+NH3↑+3NaCl+3NaOH,故溶液X中大量存在的阴离子有Cl-、OH-,故答案为:NH4Cl+2HCl![]() 3H2↑+NCl3;Cl-、OH-。
3H2↑+NCl3;Cl-、OH-。
(4)①由于碘单质与淀粉溶液变为蓝色,因此在V中加入的指示剂通常为淀粉溶液;在用硫代硫酸钠标准溶液滴定前溶液中存在I2,溶液为蓝色,随着溶液的滴定,溶液中c(I2)逐渐减小,溶液的颜色逐渐变浅,当滴加最后一滴溶液中,溶液由蓝色变为无色,半分钟内不褪色,就证明达到了达到终点。因此至终点的现象是溶液由蓝色变为无色,且半分钟内溶液颜色不再改变;④根据反应方程式:2ClO2+10I-+8H+=2Cl-+5I2+4H2O;I2+2S2O32-=2I-+S4O62-可得关系式:2ClO2—5I2—10S2O32-;n(S2O32-)=0.1000mol·L-1×0.02L=0.002mol,则n(ClO2)=2/10×0.002mol=0.0004mol,测得混合气中ClO2的质量为m(ClO2)=0.0004mol×67.5g/mol=0.02700g,故答案为:溶液由蓝色变为无色,且半分钟内溶液颜色不再改变;0.02700。
②A.滴定管未润洗就直接注入硫代硫酸钠标准液,将会导致标准液浓度变小,导致V(标准)偏大,根据c(待测)=![]() 可以知道,滴定时,消耗的标准液偏多,使所测ClO2的含量偏高,故A不选;
可以知道,滴定时,消耗的标准液偏多,使所测ClO2的含量偏高,故A不选;
B.锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=![]() 可以知道,对测定结果无影响,故B不选;
可以知道,对测定结果无影响,故B不选;
C.滴定管读取标准液体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=![]() 可以知道,测定结果偏低,故C选。
可以知道,测定结果偏低,故C选。
故答案为:C。