题目内容
3.目前人类已发现的非金属元素除稀有气体外共有16种,下列对这16种非金属元素的相关判断:①都是主族元素,最外层电子数都大于4;②单质在反应中都只能作氧化剂;③氢化物常温下都是气态,所以又都叫气态氢化物;④氧化物常温下都可以与水反应生成酸,其中正确的有( )| A. | ①② | B. | ①③ | C. | ④ | D. | 均不正确 |
分析 ①H元素为非金属元素,最外层电子数为1;
②不少非金属元素在反应中能失去电子;
③碳原子数大于4的烃在常温下为液态或固态;
④非金属氧化物有酸性氧化物和不成盐氧化物.
解答 解:①H的最外层电子数为1,C和Si的最外层电子数为4,都不大于4,故①错误;
②非金属较弱的非金属元素在反应中能失去电子,可做还原剂,如H、C、S等,故②错误;
③碳原子数大于4的烃在常温下为液态或固态,氨气为气态,N2H4在常温下为液态,故③错误;
④CO、NO等氧化物为非金属性氧化物,但不具有酸性,为不成盐氧化物,故④错误.
故选D.
点评 本题考查非金属元素的性质,为高频考点,熟悉元素及其单质、化合物的性质即可解答,并注意利用特例来解答.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
11.下列物质的性质比较,正确的是( )
| A. | 酸性:H2SO4>HClO4>HBrO4 | B. | 碱性:RbOH>KOH>NaOH | ||
| C. | 非金属性:P>S>Cl | D. | 气态氢化物稳定性:HF>HCl>H2S |
18.下列说法正确的是( )
①煤经气化和液化两个化学变化过程,可变为清洁能源
②甲烷、乙烯和苯在工业上都可通过石油分馏得到
③食用白糖的主要成分是蔗糖
④用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率
⑤乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色
⑥纤维素、合成纤维、光导纤维都是有机高分子化合物
⑦制肥皂时,在皂化液里加入饱和食盐水,能够促进高级脂肪酸钠的析出
⑧苯酚稀溶液常用于外科消毒,所以自来水也可以用苯酚进行消毒处理
⑨重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤.
①煤经气化和液化两个化学变化过程,可变为清洁能源
②甲烷、乙烯和苯在工业上都可通过石油分馏得到
③食用白糖的主要成分是蔗糖
④用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率
⑤乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色
⑥纤维素、合成纤维、光导纤维都是有机高分子化合物
⑦制肥皂时,在皂化液里加入饱和食盐水,能够促进高级脂肪酸钠的析出
⑧苯酚稀溶液常用于外科消毒,所以自来水也可以用苯酚进行消毒处理
⑨重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤.
| A. | ②④⑤⑦⑧ | B. | ①③④⑦⑨ | C. | ①⑤⑥⑧⑨ | D. | ①②③⑤⑥ |
8.有机物的种类繁多,但其命名中是有规则的.下列有机物命名正确的是( )
| A. | CH3(CH2)4CH3 1,4-二甲基丁烷 | |
| B. | CH3CH(CH3)CH=CH2 甲基丁烯 | |
| C. | CH3CH2CH(CH3) CH2OH 2-甲基-1-丁醇 | |
| D. | CH2ClCH2Cl 二氯乙烷 |
15.在实验室里可用如图1所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.

图1中:①为氯气发生装置;②的试管里盛有15mL 30% KOH溶液,并置于水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里盛有紫色石蕊溶液.
请回答下列问题:
(1)仪器a的名称是锥形瓶.
(2)实验室制取氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(填字母代号)的净化装置.
A.碱石灰B.饱和食盐水C.浓硫酸D.饱和碳酸氢钠溶液
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是制取温度不同、制取时碱的浓度也不同.反应完毕经冷却后,②的试管中有大量晶体析出.在图2中符合该晶体溶解度曲线的是M(填字母代号);从②的试管中分离出晶体的操作是过滤,该操作需要用到的玻璃仪器有普通漏斗、玻璃棒、烧杯.
(4)次氯酸钠中存在的化学键类型为离子键、共价键.
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请完成下表中的空白:
(6)装置⑤的作用是吸收尾气,防止污染.

图1中:①为氯气发生装置;②的试管里盛有15mL 30% KOH溶液,并置于水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里盛有紫色石蕊溶液.
请回答下列问题:
(1)仪器a的名称是锥形瓶.
(2)实验室制取氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(填字母代号)的净化装置.
A.碱石灰B.饱和食盐水C.浓硫酸D.饱和碳酸氢钠溶液
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是制取温度不同、制取时碱的浓度也不同.反应完毕经冷却后,②的试管中有大量晶体析出.在图2中符合该晶体溶解度曲线的是M(填字母代号);从②的试管中分离出晶体的操作是过滤,该操作需要用到的玻璃仪器有普通漏斗、玻璃棒、烧杯.
(4)次氯酸钠中存在的化学键类型为离子键、共价键.
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请完成下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为浅黄绿色色 | 继续通入的氯气溶于水使溶液呈浅黄绿色 |
12.下列说法不正确的是( )
| A. | CH3-CH=CH2和CH2=CH2的最简式相同 | |
| B. | CH≡CH和C6H6含碳量相同 | |
| C. | 乙炔和苯互为同系物 | |
| D. | 正戊烷、异戊烷、新戊烷的沸点逐渐降低 |
13.能正确表示下列化学反应的离子方程式的是( )
| A. | 氢氧化钡溶液与硫酸的反应OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
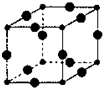 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.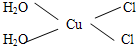 .
.