题目内容
11.下列物质的性质比较,正确的是( )| A. | 酸性:H2SO4>HClO4>HBrO4 | B. | 碱性:RbOH>KOH>NaOH | ||
| C. | 非金属性:P>S>Cl | D. | 气态氢化物稳定性:HF>HCl>H2S |
分析 A.非金属性越强最高价含氧酸的酸性越强;
B.金属性越强最高价氧化物对应水化物的碱性越强;
C.同周期从左到右非金属性增强;
D.非金属性越强氢化物越稳定.
解答 解:A.非金属性越强最高价含氧酸的酸性越强,酸性:HClO4>HBrO4>H2SO4,故A错误;
B.同主族自上而下金属性增强,金属性越强最高价氧化物对应水化物的碱性越强,故碱性:RbOH>KOH>NaOH,故B正确;
C.同周期从左到右非金属性增强,所以非金属性:P<S<Cl,故C错误;
D.非金属性:S<Cl<F,所以稳定性为:HF>HCl>H2S,故D正确;
故选BD.
点评 本题考查同周期同主族性质递变规律、元素的非金属性等,难度不大,注意规律的掌握理解.

练习册系列答案
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
1.如图所示的装置能够组成原电池产生电流的是( )
| A. | 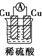 | B. |  | C. | 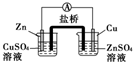 | D. | 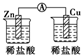 | ||||
| E. | 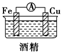 | F. |  |
19.下列有机物的命名正确的是( )
| A. | 2─乙基戊烷 | B. | 2,3,3─三甲基丁烷 | ||
| C. | 2─甲基-3-丁醇 | D. | 2,3-二乙基-1-戊烯 |
6.下列有机物命名正确的是( )
| A. | 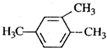 1,3,4-三甲基苯 1,3,4-三甲基苯 | B. | 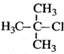 2-甲基-1-氯丙烷 2-甲基-1-氯丙烷 | ||
| C. | 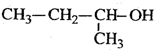 2-甲基-1-丙醇 2-甲基-1-丙醇 | D. | 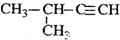 2-甲基-3-丁炔 2-甲基-3-丁炔 |
3.目前人类已发现的非金属元素除稀有气体外共有16种,下列对这16种非金属元素的相关判断:①都是主族元素,最外层电子数都大于4;②单质在反应中都只能作氧化剂;③氢化物常温下都是气态,所以又都叫气态氢化物;④氧化物常温下都可以与水反应生成酸,其中正确的有( )
| A. | ①② | B. | ①③ | C. | ④ | D. | 均不正确 |
20.设NA为阿伏加德罗常数,则下列说法不正确的是( )
| A. | 0.1mol乙炔分子中含有的共用电子对数目为0.5NA | |
| B. | 常温常压,1.6g甲烷含有的质子数为NA | |
| C. | 14g乙烯和环丙烷混合物中含有的碳原子数目为NA | |
| D. | 在标准状态下,2.24L己烷含有的氢原子数目为1.4NA |
1.下列化学反应的离子方程式正确的是( )
| A. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 往FeCl3溶液中加入Fe粉:2Fe3++Fe═3Fe2+ | |
| C. | 硅酸钠与盐酸反应:SiO32-+2H+═H2 SiO3↓ | |
| D. | 三氧化硫与氢氧化钙溶液的反应:SO3 +2OH-═SO42-+H2O |
 N和B元素及其化合物在工农生产中有很重要的应用.
N和B元素及其化合物在工农生产中有很重要的应用.