题目内容
17.有机物F (C9H10O2) 是一种有茉莉花香味的酯.用如图所示的方法可以合成F.其中A是相对分子质量为28的烃,其产量常作为衡量石油化工发展水平的标志.E是只含碳、氢、氧的芳香族化合物,且苯环上只有一个侧链.
回答下列问题:
(1)A的分子式是C2H4;A的结构简式是CH2=CH2
(2)B的官能团名称是羟基;
(3)为检验C中的官能团,可选用的试剂是银氨溶液或新制氢氧化铜;
(4)反应④的化学方程式是
 .
.
分析 A是相对分子质量为28的烃,其产量常作为衡量石油化工发展水平的标志,则A为CH2=CH2;乙烯通过反应生成B,B可以连续发生氧化反应生成D,故B为醇、D为羧酸,则反应①是乙烯与水发生加成反应生成B为CH3CH2OH,则C为CH3CHO,D为CH3COOH;有机物F(C9H10O2)是一种有茉莉花香味的酯,由芳香族化合物E与D反应得到,结合D、F的分子式可知,E的分子式为C7H8O,且苯环上只有一个侧链,故E为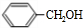 ,F为
,F为 ,据此进行解答.
,据此进行解答.
解答 解:A是相对分子质量为28的烃,其产量常作为衡量石油化工发展水平的标志,则A为CH2=CH2.可以连续发生氧化反应生成D,故B为醇,D为羧酸,则反应①是乙烯与水发生加成反应生成B为CH3CH2OH,则C为CH3CHO,D为CH3COOH,有机物F(C9H10O2)是一种有茉莉花香味的酯,由芳香族化合物E与D反应得到,结合D、F的分子式可知,E的分子式为C7H8O,且苯环上只有一个侧链,故E为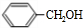 ,F为
,F为 ,
,
(1)A为CH2=CH2,分子式是C2H4,乙烯分子中含有碳碳双键,乙烯的结构简式为:CH2=CH2,
故答案为:C2H4;CH2=CH2;
(2)由上述分析可知,B的结构简式是CH3CH2OH,含有的官能团为羟基,
故答案为:羟基;
(3)C为CH3CHO含有官能团为醛基,可用新制氢氧化铜或银氨溶液检验醛基,
故答案为:银氨溶液或新制氢氧化铜;
(4)反应④为乙酸与苯甲醇发生的酯化反应,反应的化学方程式为: ,
,
故答案为: .
.
点评 本题考查有机物推断,题目难度中等,首先根据信息判断A为乙烯,再根据B连续发生氧化反应确定B为乙醇、D为乙酸,结合分子式确定E的结构,要求学生熟练掌握官能团的性质与转化.

练习册系列答案
相关题目
8.下列离子方程式正确的是( )
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| C. | 向NaHCO3溶液中加过量Ca(OH)2溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
12.己烯雌酚是一种激素类药物,结构如下,下列有关叙述中不正确的是( ) 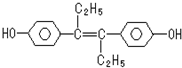

| A. | 该药物可以用有机溶剂萃取 | |
| B. | 可与NaOH反应但是不与Na2CO3发生反应 | |
| C. | 1mol该有机物不可以Br2发生取代反应 | |
| D. | 该有机物分子中,可能有16个碳原子共平面 |
9.欲除去下列物质中混入的少量杂质(括号内物质为杂质),不能达到目的是( )
| A. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡静置后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 溴苯(溴):加入CCl4溶液,充分振荡静置后,分液 | |
| D. | 苯中混有苯酚,加入氢氧化钠溶液,再用分液漏斗分液 |
6.X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为互为同位素;R在元素周期表中的位置是第3周期ⅦA族.
(2)Z的单质与水反应的化学方程式是2Na+2H2O═2NaOH+H2↑;R与Q两元素最高价氧化物水化物反应的离子方程式3H++Al(OH)3═Al3++3H2O.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是b、c(填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是0.099nm-0.144nm;写出工业制取Y的单质的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
| X | Y | Z | M | R | Q | |
| 原子半 径/nm | 0.154 | 0.074 | 0.099 | 0.143 | ||
| 主要 化合价 | -4, +4 | -2 | -1,+7 | +3 | ||
| 其他 | 阳离子核 外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Z的单质与水反应的化学方程式是2Na+2H2O═2NaOH+H2↑;R与Q两元素最高价氧化物水化物反应的离子方程式3H++Al(OH)3═Al3++3H2O.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是b、c(填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是0.099nm-0.144nm;写出工业制取Y的单质的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
7.设NA表示阿伏加德罗常数,下列说法不正确的是( )
| A. | 1mol氯气参加氧化还原反应,转移的电子数一定为2 NA | |
| B. | 0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3NA | |
| C. | 常温常压下,44g二氧化碳分子中所形成的共用电子对数为4NA | |
| D. | 常温常压下,1.6gO2和O3混合气体中质子总数为0.8NA |

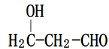 .
.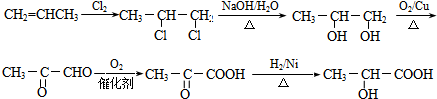 .
.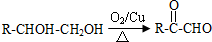

 ; F
; F  ;
; +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;
+2H2O;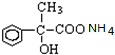 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.