题目内容
9.下列说法中正确的是( )| A. | 40g SO3气体所占有的体积为11.2L | |
| B. | 1mol固体NaHCO3所含有的阴阳离子总数为3NA | |
| C. | 1mol/L的CH3COOH溶液中,CH3COO-总数小于NA | |
| D. | 常温常压下,32gO2和O3的混合气体含氧原子数为2NA |
分析 A.没有告诉三氧化硫气体的摩尔体积,无法计算40g三氧化硫的体积;
B.1mol固体碳酸氢钠中含有1mol钠离子和1mol碳酸氢根离子;
C.缺少溶液体积,无法计算溶液中醋酸根离子数目;
D.氧气和臭氧都是有氧原子组成,32g混合物中含有32g氧原子,含有2mol氧原子.
解答 解:A.40g三氧化硫的物质的量为:$\frac{40g}{80g/mol}$=0.5mol,题中没有告诉三氧化硫的气体摩尔体积,无法计算0.5mol三氧化硫所占有的体积,故A错误;
B.1mol固体碳酸氢钠中含有1mol钠离子和1mol碳酸氢根离子,总共含有2mol离子,所含有的阴阳离子总数为2NA,故B错误;
C.没有告诉醋酸溶液体积,无法计算溶液中醋酸根离子的数目,故C错误;
D.32gO2和O3的混合气体中含有32g氧元素,含有氧原子的物质的量为:$\frac{32g}{16g/mol}$=2mol,含氧原子数为2NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,C为易错点,注意题中缺少溶液体积.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.已知在25℃、101kPa下,1g C8H18(l)燃烧生成CO2和液态H2O时放出48.40kJ的热量,表示上述反应的热化学方程式正确的是( )
| A. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-48.40 kJ•mol-1 | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-5 517.6 kJ•mol-1 | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=+5 517.6 kJ•mol-1 | |
| D. | 2C8H18(l)+25O2(g)═16CO2(g)+18 H2O(l)△H=-5 517.6 kJ•mol-1 |
4.有部分元素的性质与原子(或分子)结构如下表:
(1)写出元素T的原子结构示意图: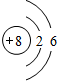 .
.
(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示).下列表述中能证明这一事实的是cd(填序号).
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物对应的水化物的碱性比Z强
(3)写出T与Y形成的化合物的化学式Na2O,Na2O2.
(4)元素T和氢元素以原子个数比1:1化合形成化合物Q,元素X与氢元素以原子个数比1:2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:N2H4+2H2O2═N2↑+4H2O.
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的简单离子中半径最小 |
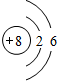 .
.(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示).下列表述中能证明这一事实的是cd(填序号).
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物对应的水化物的碱性比Z强
(3)写出T与Y形成的化合物的化学式Na2O,Na2O2.
(4)元素T和氢元素以原子个数比1:1化合形成化合物Q,元素X与氢元素以原子个数比1:2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:N2H4+2H2O2═N2↑+4H2O.
18.有A、B、C三种短周期元素,已知A元素的原子最外层电子数等于其电子层数,B元素的原子最外层电子数是其电子层数的2倍,C元素的原子最外层电子数是其电子层数的3倍.由三种元素组成的化合物的化学式不可能是( )
| A. | A3BC4 | B. | A2(BC4)3 | C. | A2BC3 | D. | A2BC4 |
 某兴趣小组设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.
某兴趣小组设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.
 (1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如图所示实验以确认上述混和气体中有C2H4和SO2. (乙烯的制取装置略)
(1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如图所示实验以确认上述混和气体中有C2H4和SO2. (乙烯的制取装置略)