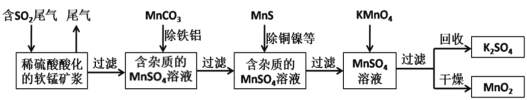
��Ŀ����
����Ŀ��������о����֣����������������̣�MnFe2O4�����������Ȼ�ѧѭ���ֽ�ˮ���⣬����ܵ��������ҵ�������MnFe2O4���Ʊ��������£�

(1)ԭ��Fe(NO3)n��n=______��Ͷ��ԭ��Fe(NO3)n��Mn��NO3��2�����ʵ���֮��ӦΪ______��
(2)������С��������衱��Ŀ����______����������ϴ�Ӹɾ��ı���______��
(3)����MnFe2O4�Ȼ�ѧѭ������ķ�Ӧ�ɱ�ʾΪ:MnFe2O4![]() MnFe2O4��x+
MnFe2O4��x+![]() O2����MnFe2O4��x+xH2O��MnFe2O4+xH2�����������������������Ӧ���ش��������⣺
O2����MnFe2O4��x+xH2O��MnFe2O4+xH2�����������������������Ӧ���ش��������⣺
����MnFe2O4��x��x=0.6����MnFe2O4��x��Fe2+ռȫ����Ԫ�صİٷ���Ϊ______��
�ڸ��Ȼ�ѧѭ�����ⷨ���ŵ���______�������㼴�ɣ���
�۸��Ȼ�ѧѭ�����������в���֮������һ���Ľ����о�������______��
���𰸡�n=3 242��189 ��ַ�Ӧ��������ȫ ϴ��������Һ������ 60% ���й��̼���Լ����������Ⱦ���������۲���ѭ��ʹ�ü������������ڲ�ͬ��������,��˲����ڸ�����������������ŵ� Ѱ�Һ��ʵĴ���,ʹMnFe2O4�ֽ��¶Ƚ��ͻ��ҷֽ��¶ȸ��͵�������
��������
Fe(NO3)3��Mn(NO3)2��Ͻ��裬����KOH��Һ������pH��10.4����Fe3+��Mn2+������ϴ�ӳ�����������ĥ�ɵ�MnFe2O4���ݴ˷������
(1)MnΪ+2�ۣ���MnFe2O4��Fe�Ļ��ϼ�Ϊ+3�ۣ���Fe(NO3)n��n=3����MnFe2O4�п�֪��Fe��Mn�ĸ���֮��Ϊ2��1������Fe(NO3)3��Mn(NO3)2 ���ߵ����ʵ���֮�� 2��1������������֮��Ϊ��242��2��179=484��179���ʴ�Ϊ��3��484��179��
(2)����������Ϊ����Fe(NO3)n��Mn(NO3)2��ַ�Ӧ��������Һ�Լ��ԣ���ϴ����ϴ��ҺΪ����ʱ��˵��������û����Һ�е����ӣ��������Ѿ�ϴ�Ӹɾ����ʴ�Ϊ����ַ�Ӧ�������ȫ�����һ��ϴ��Һ�����ԣ�
(3)��x=0.6ʱ�������ܼ�̬Ϊ(4-0.6)��2-2=4.8����1mol MnFe2O4-0.6�к�Fe2+��Fe3+���ʵ����ֱ�Ϊamol��bmol������a+b=2��2a+3b=4.8��������ã�a=1.2��b=0.8����1mol MnFe2O4-0.6�к�Fe2+�����ʵ���Ϊ1.2mol����Fe2+ռ�İٷ���Ϊ![]() ��100%=60%���ʴ�Ϊ��60%��
��100%=60%���ʴ�Ϊ��60%��
��������ͼ���Կ������Ȼ�ѧѭ�����ⷨ���̼���Լ����������Ⱦ���������۲���ѭ��ʹ�ü������������ڲ�ͬ�������ɣ������ڸ�����������������ŵ㣬�ʴ�Ϊ�����̼���Լ����������Ⱦ���������۲���ѭ��ʹ�ü������������ڲ�ͬ�������ɣ������ڸ�����������������ŵ㣻
����������Ľ϶����Դ�����Ȼ�ѧѭ�����ⷨ�ĸĽ�����ͨ��Ѱ�Һ��ʵĴ�����ʹMnFe2O4�ֽ��¶Ƚ��ͻ�ֽ��¶ȸ��͵�������ʴ�Ϊ��Ѱ�Һ��ʵĴ�����ʹMnFe2O4�ֽ��¶Ƚ��ͻ�ֽ��¶ȸ��͵������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����һ���¶��£�������X������Y ��0.16 mol����10 L �����ܱ������У�������Ӧ��X��g��+ Y��g��![]() 2Z��g�� ��H < 0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±�������˵����ȷ����
2Z��g�� ��H < 0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±�������˵����ȷ����
t / min | 2 | 4 | 7 | 9 |
n��Y��/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.��Ӧǰ2min��ƽ������v��Z��=2.0��10-5 mol/��L��min��
B.�����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv���棩��v������
C.���¶��´˷�Ӧ��ƽ�ⳣ��K=1.44
D.�����������䣬�ٳ���0.2 mol Z��ƽ��ʱX�����ʵ���Ũ�ȼ�С