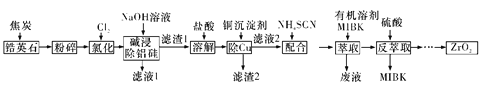
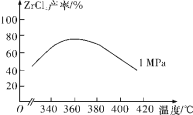
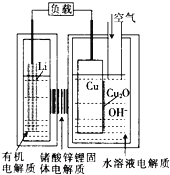
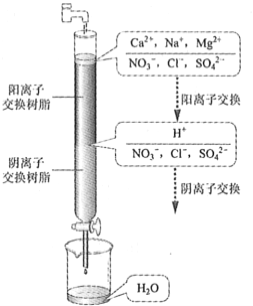
题目内容
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + aNa2O2=2Na2FeO4 + bX + 2Na2SO4 +cO2↑该反应中物质X应是__________,b与c的关系是_______________。
(2)湿法制备高铁酸钾反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:__________________。
②每生成1mol FeO42-转移_____________mol电子,若反应过程中转移了0.3mol电子,则还原产[物的物质的量为_____________mol。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(3)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子及其物质的量是_______________________________。
(4)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c为________________________________(用含a、b的代数式表示)。
【答案】Na2O b=2c 3ClO-+2Fe(OH)3+4OH-=2FeO42-+3Cl-+5H2O 3 0.15 n(I-)=2mol,n(Fe2+)=2mol c=![]()
【解析】
Ⅰ.(1)反应中铁元素由+2价升高到+6价,过氧化钠中的部分氧由-1价升高到0价,根据氧化还原反应中元素化合价升降守恒规律,过氧化钠中的另一部分氧一定会由-1价降低到-2价,反应中硫、铁原子已经守恒,故X只能为Na2O,配平后方程式为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,可知b=2c,故答案为:Na2O;b=2c;
(2)①高铁酸钾是生成物,则Fe(OH)3是反应物,该反应中Fe元素化合价由+3价变为+6价,则Fe(OH)3是还原剂,还需要氧化剂参加反应,ClO-具有强氧化性,所以ClO-是反应物,生成物是Cl-,Cl元素化合价由+1价变为-1价,转移电子数为6,溶液在碱性条件下进行,则氢氧化根离子参加反应,生成水,反应的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
②2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O中Fe元素化合价由+3价升高到+6价,则该反应中转移电子数为6,每生成1molFeO42-转移电子物质的量=![]() =3mol,该反应中还原产物是氯离子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量=
=3mol,该反应中还原产物是氯离子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量=![]() =0.15mol,故答案为:3;0.15;
=0.15mol,故答案为:3;0.15;
Ⅱ.由2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Br-+2Fe3+可知,还原性强弱顺序是:I->Fe2+>Br-。
(1)向含有1molFeI2和2molFeBr2的溶液中通入2molCl2,先发生反应2I-+Cl2=I2+2Cl-,2mol碘离子完全反应需要氯气1mol,然后发生反应Cl2+2Fe 2+=2Cl-+2Fe3+,1mol氯气反应需要亚铁离子的物质的量是2mol,溶液中含有3mol亚铁离子,参加反应的亚铁离子的物质的量是2mol,所以溶液中还剩余亚铁离子1mol,所以被氧化的离子是2molI-、2molFe 2+,故答案为:n(I-)=2mol、n(Fe2+)=2mol;
(2)若向含amolFeI2和bmolFeBr2的溶液中通入cmolCl2,当I-、Fe2+、Br-完全被氧化时,Fe2+失去的电子的物质的量为(a+b)mol,I-失去的电子的物质的量为2amol,Br-失去的电子的物质的量为2bmol,则共失去3(a+b)mol电子,所以需要氯气的物质的量:c=![]() mol,故答案为:c=
mol,故答案为:c=![]() 。
。

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】下列所陈述的事实与解释均正确的是
选项 | 实验操作及现象 | 实验结论 |
A | 用pH试纸测定NaClO溶液的酸碱性,试纸显蓝色 | NaClO水解显碱性 |
B | 收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,气体颜色变浅 | 生成的红棕色NO2气体部分转化为无色气体 |
C | 向某溶液中加入几滴新制的氯水,再加入2滴KSCN溶液,溶液变为红色 | 原溶液中一定含有Fe2+ |
D | 甲苯能使酸性高锰酸钾溶液褪色 | 发生了萃取 |
A.AB.BC.CD.D