题目内容
【题目】某班学生通过分组实验测定酸碱滴定曲线。
实验用品:0.1 mol·L-1HCl溶液、0.1 mol·L-1NaOH溶液、蒸馏水、pH计、酸式滴定管、碱式滴定管、铁架台(带滴定管夹)、锥形瓶。甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00 mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,其中乙和丙两组同学的操作上都存在着不足或失误。
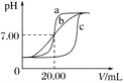
请回答下列问题:
(1)实验前pH计应用标准溶液进行校准,若将pH计放入c(H+)=0.0001 mol·L-1的标准溶液中校准,则pH计的读数应为________。
(2)甲组同学滴定时选用的滴定管为________(填“酸式”或“碱式”)滴定管,最后一次润洗滴定管应选用实验用品中的________进行润洗。
(3)乙组同学操作上的不足之处是________________________________________。
(4)造成丙组同学的曲线与甲组同学不同的原因可能是________(填字母)。
A.用待装液润洗锥形瓶
B.滴定使用的滴定管的尖嘴部分在滴定前有气泡未排出,滴定后气泡消失
C.滴定前后对滴定管进行读数的视线分别如图所示

【答案】4.00 碱式 0.1 mol·L-1NaOH溶液 在滴定终点附近测试和记录pH的间隔太大 AB
【解析】
(1)一般来说,pH计的读数可以精确到小数点后2位,pH=-lgc(H+)=-lg 0.0001=4.00。故答案为:4.00;
(2)图象分析,随加入溶液反应,溶液pH增大,甲同学所进行的实验为用0.1 mol·L-1NaOH溶液滴定20.00 mL的0.1 mol·L-1HCl溶液,故所用的滴定管应为碱式滴定管,最后一次润洗时要使用0.1 mol·L-1NaOH溶液。故答案为:碱式;0.1 mol·L-1NaOH溶液;
(3)b曲线没有像曲线a那样,有非常明显的突变过程,是由于在滴定终点附近pH的测定时,pH间隔过大,取得数据较少;故答案为:在滴定终点附近测试和记录pH的间隔太大 ;
(4)滴定至终点时丙所用体积NaOH比甲、乙多,
A、用待测液润洗锥形瓶,HCl偏多,消耗的NaOH也偏多,A符合题意;
B、滴定前有气泡未排出,滴定后气泡消失,造成记录的NaOH的体积偏大,B符合题意;
C、滴定前仰视,滴定后俯视,会使测得的NaOH溶液体积较少,C不符合题意;
故答案为:AB。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案