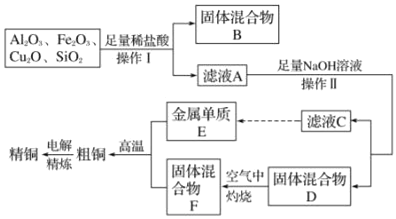
题目内容
【题目】下列物质的转化在给定条件下能实现的是( )
①Fe![]() Fe2O3
Fe2O3![]() Fe2(SO4)3
Fe2(SO4)3
②SiO2![]() Na2SiO3
Na2SiO3![]() H2SiO3
H2SiO3
③AlCl3![]() Al
Al![]() NaAlO2
NaAlO2
④Na![]() Na2O
Na2O![]() NaOH
NaOH
⑤SO2![]() H2SO3
H2SO3![]() H2SO4
H2SO4
⑥饱和NaCl(ag)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
A. ①②⑤B. ②③⑥C. ②⑤⑥D. ①③④
【答案】C
【解析】
①铁在氧气中燃烧生成四氧化三铁,得不到氧化铁,故①错误;
②二氧化硅和氢氧化钠反应:2NaOH+SiO2═Na2SiO3+H2O,硅酸钠和盐酸反应:Na2SiO3+2HCl=H2SiO3↓+2NaCl,故②正确;
③氯化铝固体是共价化合物,由分子构成,无离子,无法电解,所以得不到铝,故③错误;④钠在氧气中点燃时生成过氧化钠,得不到氧化钠,故④错误;
⑤二氧化硫和水反应:SO2+H2O![]() H2SO3,亚硫酸和氧气反应2H2SO3+O2═2H2SO4,故⑤正确;
H2SO3,亚硫酸和氧气反应2H2SO3+O2═2H2SO4,故⑤正确;
⑥在饱和NaCl溶液中通入NH3和CO2,反应生成碳酸氢钠:NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓,碳酸氢钠受热分解生成碳酸钠,2NaHCO3![]() Na2CO3+H2O+CO2↑,故⑥正确。
Na2CO3+H2O+CO2↑,故⑥正确。
所以在给定条件下能实现转化的是②⑤⑥。
故选C。

 阅读快车系列答案
阅读快车系列答案【题目】高纯二氧化硅可用来制造光纤。某蛇纹石的成分见下表:
组分 | SiO2 | MgO | Na2O | K2O | Fe2O3 |
质量分数/% | 59.20 | 38.80 | 0.25 | 0.50 | 0.8 |
通过下图流程可由蛇纹石制备较纯净的二氧化硅。
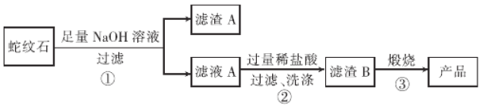
(1)蛇纹石中涉及的可溶性金属氧化物有____________(写化学式)。
(2)步骤①中涉及SiO2反应的离子方程式为________________。
(3)滤渣A 的成分有______________________(填化学式)。
(4)步骤②中洗涤沉淀的方法是_____________________。
(5)步骤③反应的化学方程式为______________________;实验室进行步骤③需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、和________________。
【题目】(一)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于____晶体,SeO2中Se原子采取的杂化类型为___。
(二)A、X、Y、Z、W、M、G等原子序数一次增大的前四周期元素
元素 | 相关信息 |
A | 原子核外电子总数与其周期数相同 |
X | 其羞态原子的L层中有3个未成对电子 |
Y | 荃态原子的2p轨道上有一个电子的自旋方向与2p轨道上其它电子的自旋方向相反 |
Z | 原子核外p电子数比s电子数多l个 |
W | 原子的第一至第四电离能(kJ·mol-1)分别是:I1=578,I2=1817 I3=2745 I4=11575 |
M | 元素的主族数与周期数相差4 |
G | 其基态原子最外层电子数为1,其余各电子层均充满电子 |
(1)画出W基态原子的核外电子排布图______。
(2)A2Y的VSEPR模型名称为____。
(3)已知为X2Y分子中Y原子只与一个X原子相连,请根据等电子原理,写出X2Y的电子式____。
(4)X、G形成的某种化合物的晶胞结构如图所示,则其化学式为______。

(5)已知Z和M形成的化合物的晶体密度为pg·cm-3,阿伏加德罗常效为NA,该晶体中两个距离最近的Z离子中心间距离为_____cm。