��Ŀ����
����Ŀ��I�� ������һ�ֳ��õĻ���ԭ�ϣ�Ӧ��ʮ�ֹ㷺��
��1����H2�ϳ�����CO(NH2)2���й��Ȼ�ѧ����ʽ�У�
��N2(g)��3H2(g)===2NH3(g) ��H1����92.4 kJ��mol��1
��NH3(g)��1/2CO2(g)===1/2NH2CO2NH4(s) ��H2����79.7 kJ��mol��1
��NH2CO2NH4(s)===CO(NH2)2(s)��H2O(l) ��H3����72.5 kJ��mol��1
��N2(g)��H2(g)��CO2(g)��Ӧ����CO(NH2)2(s)��H2O(l)���Ȼ�ѧ����ʽΪ_______________________________________________________��
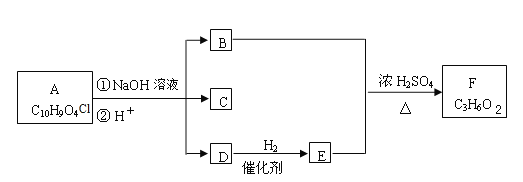
II��ijͬѧ�����һ��绯ѧװ������ͼ��ʾ��������װ����XΪ�����ӽ���Ĥ���״�(CH3OH)���п�ȼ�ԡ�
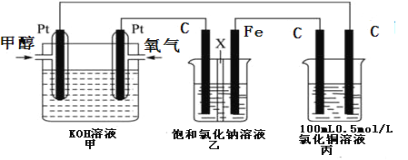
����Ҫ��ش�������⣺
��2��д��װ�ü��и����ĵ缫��Ӧʽ��_______________________________________��
��3��װ������ʯī�缫��C���ĵ缫��ӦʽΪ��_________________________________��
��4����װ�ü�������0.05molO2ʱ����װ��������������������___________L(�����)��װ��������Һ��pHΪ___________����Һ���Ϊ200mL���䣩��Ҫʹ���ձ��е���Һ�ָ���ԭ����״̬����Ҫ�����������___________��
���𰸡�N2(g)��3H2(g)��CO2(g)===CO(NH2)2(s)��H2O(l)�� ��H����179.3 kJ��mol��1 CH3OH -6e+8OH�TCO32+6H2O 2Cl ��2e=Cl2�� 1.68 14 HCl
��������
I�����ݸ�˹���ɼ��㣻
II����װ����ȼ�ϵ�أ��״��ڸ���ͨ�룬����������ͨ�룬�Һͱ�װ���ǵ��أ�����̼�������������缫���������������̼�����������Ҳ�̼����������������ӵķŵ�˳���ӵ�ʧ�غ�������
I����1����֪��
��N2(g)��3H2(g)��2NH3(g) ��H1����92.4 kJ��mol��1
��NH3(g)��1/2CO2(g)��1/2NH2CO2NH4(s) ��H2����79.7 kJ��mol��1
��NH2CO2NH4(s)��CO(NH2)2(s)��H2O(l) ��H3����72.5 kJ��mol��1
����ݸ�˹���ɿ�֪��+�ڡ�2+�ۼ��õ�N2(g)��H2(g)��CO2(g)��Ӧ����CO(NH2)2(s)��H2O(l)���Ȼ�ѧ����ʽΪN2(g)��3H2(g)��CO2(g)��CO(NH2)2(s)��H2O(l) ��H����179.3 kJ��mol��1��
II����2��ȼ�ϵ���ǽ���ѧ��ת��Ϊ���ܵ�װ�ã�����ԭ��أ�Ͷ��ȼ�ϵĵ缫�Ǹ�����Ͷ���������ĵ缫������������ͨ�������ĵ缫�������������ϼ״�ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ���缫��ӦΪCH3OH-6e��+8OH����CO32��+6H2O��
��3���ҳ�����ӵ�Դ���ڵ��أ����缫����ԭ��صĸ�������������������ʯī�缫�������������������ӷŵ������������缫��ӦʽΪ2Cl�D�D2e����Cl2����
��4����װ�ü�������0.05molO2ʱ���ɵ缫����ʽO2+2H2O+4e-��4OH-��֪ת��0.2mol���ӣ�װ�ñ��������缫��ӦΪ��2Cl�D�D2e����Cl2����4OH--4e-��2H2O+O2�����Ȼ�ͭ���ʵ���=0.1L��0.5mol/L=0.05mol��n��Cl-��=0.1mol��������������ת��0.1mol�������������ʵ���0.05mol�������������ӵ�ⷴӦ����ת��0.1mol����������0.025mol�������������ʵ���=0.05mol+0.025mol=0.075mol����״�����������=0.075mol��22.4L/mol=1.68L��װ��������������2H2O+2e-��H2+2OH-����֪����0.2molOH-����Һ���Ϊ200mL����c��OH-��=1mol/L������pH=14����ⱥ���Ȼ�����Һ����������������Ҫʹ���ձ��е���Һ�ָ���ԭ����״̬����Ҫ�����������HCl��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ������ͼװ����ȡ���е����ָ�����������壨ͼ������̨�����С����ȼ������ռ�װ�þ�����ȥ����Ҫʱ���Լ��ȣ�a��b��c��d��ʾ��Ӧ�����м�����Լ�����������ȷ���ǣ� ��

ѡ�� | ���� | a | b | c | d |
A | CO2 | ���� | CaCO3 | ����Na2CO��Һ | Ũ���� |
B | Cl2 | Ũ���� | MnO2 | NaOH��Һ | Ũ���� |
C | NH3 | ����NH4Cl��Һ | ��ʯ�� | H2O | ����NaOH |
D | NO | ϡ���� | ͭм | H2O | Ũ���� |
A. A B. B C. C D. D