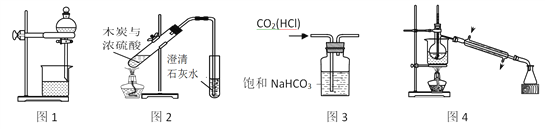
题目内容
【题目】如图所示装置是化学实验室中的常用装置,它有多种用途,以下各项用途和操作都正确的是 ( )
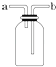
A.洗气或干燥装置:瓶内放一定体积溶液,由a管口进气
B.用于收集难溶于水的气体:瓶内充满水,由b管口进气
C.提供少量CO:瓶内充满CO,b管口接自来水龙头
D.H2S和SO2反应的装置:由a管口通入H2S,b管口通入SO2
【答案】C
【解析】
A.作为洗气或干燥装置时,瓶内放一定体积溶液,由b管口进气,A错误;
B.排水法收集气体时,瓶内充满水,从a管口进气,B错误;
C. 瓶内充满CO,b管口接自来水龙头,在压强作用下气体从a管口逸出,C正确;
D H2S的密度比SO2小,为充分混合反应,应由a管口通入SO2,b管口通入H2S,D错误;
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ.在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g)![]() 2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1,容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:
2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1,容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:
时间t/ h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
| 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列问题:
(1)下列能提高A的转化率的是____。
A 升高温度 B 体系中通入A气体
C 将D的浓度减小 D 通入稀有气体He,使体系压强增大到原来的5倍
E 若体系中的C为HCl,其它物质均难溶于水,滴入少许水
(2)该反应的平衡常数表达式K=___;前2小时C的反应速率是____;计算平衡时A的转化率_____。
(3)若将容器改为恒压容器,改变条件,使反应达到与上述相同的转化率,则达到平衡时B浓度为____。(保留两位有效数字)
Ⅱ.锂的化合物用途广泛。Li3N是非常有前途的储氢材料;LiFePO4、Li2FeSiO4等可以作为电池的正极材料。请回答下列问题:
(4)氮化锂在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2![]() LiNH2+2LiH,在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的____%(精确到0.1%)。
LiNH2+2LiH,在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的____%(精确到0.1%)。
(5)将Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时制得Li2FeSiO4,写出该反应的化学方程式______。
(6)磷酸亚铁锂电池稳定性高、安全、对环境友好,该电池在充放电过程中,发生LiFePO4与Li1-xFePO4之间的转化,电池放电时负极发生的反应为LiXC6-xe- =xLi++6C,写出电池放电时的化学方程式____。
【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下:2CH4(g)![]() C2H4(g) +2H2(g) △H >0
C2H4(g) +2H2(g) △H >0
化学键 | H—H | C—H | C = C | C—C |
E(kJ / mol) | a | b | c | d |
(1)已知相关化学键的键能如表,甲烷制备乙烯反应的△H =______(用含a.b.c.d的代数式表示)。
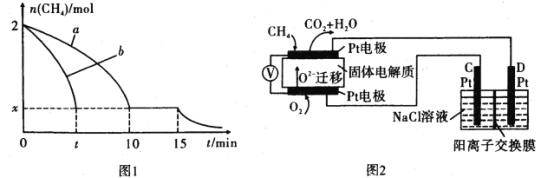
(2)T1温度时,向1L的恒容反应器中充入2 molCH4,仅发生上述反应,反应过程中0~15 min CH4的物质的量随时间变化如图1,测得10-15 min时H2的浓度为1.6molL-1
①0~10min内CH4表示的反应速率为____mol/(Lmin) o
②若图1中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (CH4)的变化曲线,其中表示催化剂表面积较大的曲线是____(填“a”或 “b”)。
③15 min时,若改变外界反应条件,导致n( CH4)发生图中所示变化,则改变的条件可能是________(任答一条即可)。
(3)实验测得:v正=K正c2(CH4),v逆=K逆c(C2H4)c2(H2),其中K正、K逆为速率常数仅与温度有关,T1温度时k正与K逆的比值为____(填数值)。若将温度由T1升高到T2,则反应速率增大的倍数V正____V逆(选填“>”、“<”或“=”);判断的理由是__________
(4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了Y2O3与ZrO2的固体,可在高温下传导O2-
①C极的Pt为_____极(选填“阳”或“阴” )。
②该电池工作时负极反应方程式为_______。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112 mL,则电解后所得溶液在25℃时pH=_____(假设电解前后NaCl溶液的体积均为500 mL)。