题目内容
6.下列说法或表达正确的是( )①活性炭、SO2和HClO都具有漂白作用,且漂白的化学原理相同
②向100mL0.1mol/L 的溴化亚铁溶液中通入0.05mol的氯气时发生反应的离子方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-
③斜长石KAlSi3O8的氧化物形式可表示为:K2O•Al2O3•3SiO2
④酸性条件下KIO3溶液与KI溶液发生反应生成I2时的离子方程式:IO3-+5I-+3H2O═I2+6OH-
⑤碳酸氢根离子的电离方程式可表示为:HCO3-+H2O?H3O↓+CO32-
⑥元素周期表中,从上到下,卤族元素的非金属性逐渐减弱,氢卤酸的酸性依次减弱
⑦500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) $?_{500℃.30MPa}^{催化剂}$ 2NH3(g)△H=38.6kJ•mol-1.
| A. | 全部 | B. | ②⑤ | C. | ②③④⑦ | D. | ②④⑦ |
分析 ①漂白原理与强氧化性、化合反应、吸附性等有关;
②氯气足量,Fe2+和Br-都完全反应;
③KAlSi3O8的写成氧化物形式要保证各元素的原子个数比不变;
④根据酸性条件下不能生成氢氧根离子,原子守恒判断;
⑤碳酸氢根离子电离产生氢离子;
⑥从上到下,卤族元素的非金属性逐渐减弱,气态氢化物的稳定性减弱;
⑦0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热不是38.6kJ.
解答 解:①活性炭、SO2和HClO都具有漂白作用,但漂白原理不同,活性炭属于吸附型漂白,二氧化硫属于结合型漂白,次氯酸属于氧化性漂白,故①错误;
②向100mL0.1mol/L的溴化亚铁溶液中通入0.05mol的氯气时,氯气足量,发生反应的离子方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故②正确;
③斜长石KAlSi3O8的写成氧化物形式为:K2O•Al2O3•6SiO2,要保证各元素的原子个数比不变,故③错误;
④酸性条件下不能生成氢氧根离子,原子得守恒,酸性条件下KIO3溶液与KI溶液发生反应生成I2时的离子方程式:IO3-+5I-+6H+═3I2+3H2O,故④错误;
⑤碳酸氢根离子的电离方程式可表示为:HCO3-+H2O?H3O++CO32-,故⑤正确;
⑥从上到下,卤族元素的非金属性逐渐减弱,气态氢化物的稳定性减弱,其水溶液中氢卤酸的酸性依次增强,故⑥错误;
⑦0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热不是38.6kJ,则热化学反应方程式中的反应热数值错误,故⑦错误;
故选B.
点评 本题考查综合元素化合物知识,为高频考点,把握物质的性质、发生的反应及热化学反应等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 选项 | 反应 | 离子方程式 | 评价 |
| A | 亚硫酸钡与盐酸反应 | BaSO3+2H+═Ba2++SO2↑+H2O | 正确 |
| B B | 向NaHSO4溶液中逐滴加入Ba(OH)2至溶液呈中性 | H++SO42-+Ba2++OH-═BaSO4+H2O | 正确 |
| C C | 铝制易拉罐去膜后放入NaOH溶液中 | 2Al+2OH-═2AlO2-+H2↑ | 错误,方程式未配平 |
| D | 少量铁粉与稀硝酸反应 | 3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | 错误,少量铁粉与稀硝酸反应应生成Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 向反应后的溶液中继续加入少量铁粉,铁粉可以继续溶解 | |
| B. | 氧化性:Ag+>Fe3+>Cu2+>Zn2+ | |
| C. | 反应后溶液的质量减轻 | |
| D. | 反应后溶液中Cu2+与Fe2+的物质的量之比为1:1 |
| A. | 1L 0.1 mol/L NaHCO3溶液中含有HCO3-数目为0.1NA | |
| B. | 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA | |
| C. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| D. | 1 mol Fe与足量稀HNO3反应,转移电子数目为2NA |
| A. | Na2O2与水反应:Na2O2+2H20═2Na++2OH-+H2↑ | |
| B. | FeSO4溶液与H2O2溶液混合:Fe2++H2O2+2H+═Fe3++2H2O | |
| C. | 向Na2SiO3溶液中通人过量的SO2:SiO32-+SO2+H2O═Na2SiO3↓+SO32- | |
| D. | NH4HCO3稀溶液与过量的Ca(OH)2溶液混合:NH4++HC03-+Ca2++2OH-═CaCO3↓+NH3•H2O+H20 |
| A. | 26 | B. | 29.1g | C. | 29.5g | D. | 24g |
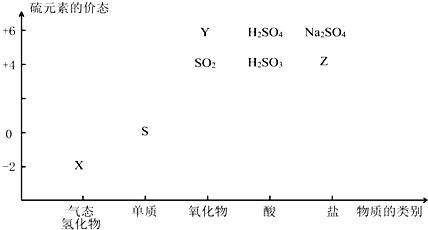
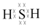 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多原子半径增大,得电子能力逐渐减弱.