题目内容
13.镁铁混合物13.8g溶解在足量某浓度的稀硝酸中,完全反应,其还原产物只有一氧化氮(0.3mol),则向反应后的溶液中加入足量的NaOH溶液,可生成的沉淀质量为( )| A. | 26 | B. | 29.1g | C. | 29.5g | D. | 24g |
分析 Fe、Mg混合物与足量硝酸反应形成硝酸镁、铁的硝酸盐,金属完全溶解,再加入足量的氢氧化钠溶液,生成沉淀为氢氧化镁、氢氧化铁,根据电荷守恒可知,金属提供的电子物质的量与氢氧化物中氢氧根的物质的量相等,根据电子转移守恒计算金属提供的电子物质的量,氢氧化物沉淀的质量为金属质量与氢氧根质量之和.
解答 解:Fe、Mg混合物与硝酸反应形成硝酸镁、铁的硝酸盐,金属完全溶解,再加入足量的氢氧化钠溶液,生成沉淀为氢氧化镁、氢氧化铁,
根据电子转移守恒可知,金属提供的电子物质的量=0.3mol×(5-2)=0.9mol,
根据电荷守恒可知,金属提供的电子物质的量与氢氧化物中氢氧根的物质的量相等,故n(OH-)=0.9mol
沉淀的质量=m(金属)+m(OH-)=13.8g+0.9mol×17g/mol=29.1g,
故选B.
点评 本题考查混合物的计算,侧重对解题方法技巧与守恒思想的考查,确定氢氧化物中氢氧根的物质的量是关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
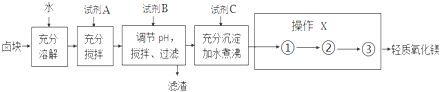
18.卤块的主要成分是MgCl2,此外还含有少量的Fe3+、Fe2+和Mn2+等离子,以卤块为原料制取轻质氧化镁工艺以及相关数据如图:
若要求产品尽量不含杂质,而且生产成本较低,请根据如表提供的资料,回答下列问题:
表1 生成氢氧化沉淀的pH
Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为 Fe3+,生成 Fe(OH)3沉淀除去
表2 原料价格表
(1)要使卤块充分溶解,可采取的措施有适当加热、搅拌、将卤块粉碎等(至少答2点)
(2)加入的试剂A,最佳的选择是漂液.
(3)为尽量除去杂质,试剂B为NaOH,当溶液的pH为9.8时,停止加入B.
(4)操作X中①②③步的操作分别是过滤、洗涤、灼烧、检验步骤②是否进行完全的操作是:取最后一次洗涤液少许做焰色反应.
(5)加入的试剂C是 Na2CO3,煮沸发生的反应方程式为MgCO3+H2O$\frac{\underline{\;加热煮沸\;}}{\;}$Mg(OH)2+CO2↑.

若要求产品尽量不含杂质,而且生产成本较低,请根据如表提供的资料,回答下列问题:
表1 生成氢氧化沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
表2 原料价格表
| 物质 | 价格/(元•吨-1) |
| 漂液(含 25.2% NaClO) | 450 |
| 双氧水(含 30% H2O2) | 2400 |
| 烧碱(含 98% NaOH) | 2100 |
| 纯碱(含 99.5% Na2CO3) | 600 |
(2)加入的试剂A,最佳的选择是漂液.
(3)为尽量除去杂质,试剂B为NaOH,当溶液的pH为9.8时,停止加入B.
(4)操作X中①②③步的操作分别是过滤、洗涤、灼烧、检验步骤②是否进行完全的操作是:取最后一次洗涤液少许做焰色反应.
(5)加入的试剂C是 Na2CO3,煮沸发生的反应方程式为MgCO3+H2O$\frac{\underline{\;加热煮沸\;}}{\;}$Mg(OH)2+CO2↑.
2. 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | H2O2分解的热化学方程式:H2O2═H2O+$\frac{1}{2}$O2△H<0 |
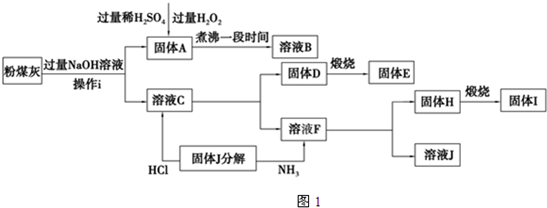
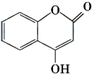 可用来制备抗凝血药,通过如图路线合成:
可用来制备抗凝血药,通过如图路线合成: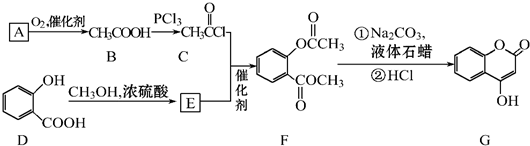
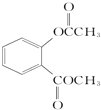 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O.