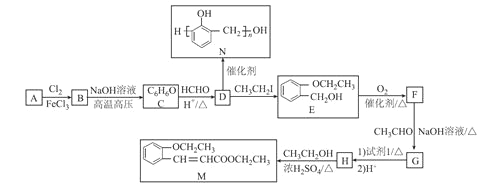
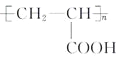题目内容
【题目】前四周期元素 R、X、Y、Z、E的原子序数依次增加,它们的结构和部分信息如下表所示:
元素代号 | 部分信息 |
R | 基态R原子核外有三个能级,每个能级上电子数相同 |
X | X的双原子单质δ键和π键数目之比为1∶2 |
Y | 短周期主族元素中,原子半径最大 |
Z | Z的最高正化合价与最低负化合价之和等于4 |
E | 基态E3+的外围电子排布式是3d5 |
回答问题:
(1)E元素在周期表中的位置是________,其基态原子中电子占据的最高能层是__________________。
(2)元素 X的氢化物M,分子内含18个电子,M的结构式为_____,每个中心原子的价层电子对数是_________________。
(3)在R、X、Z的含氧酸根离子中,互为等电子体的离子组是_________________。
(4)Z元素的两种氧化物对应的水化物中,酸性较强的________,其原因是_________________。
(5)(ZX)4在常压下,高于130℃时(ZX)4分解为相应的单质,这一变化破坏的作用力是________________;它为热色性固体,具有色温效应,低于-30℃时为淡黄色,高于100℃时为深红色.
在淡黄色→橙黄色→深红色的转化中,破坏的作用力是_________________。
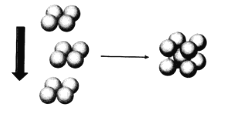
(6)常温条件下,E的晶体采用如图所示的堆积方式。则这种堆积模型的配位数为__________,若E原子的半径为r,则单质E的原子空间利用率为________________。(列出计算式即可)
【答案】 第四周期VIII族 N ![]() 4 CO32-与NO3- H2SO4 H2SO4和H2SO3可表示为(HO)2SO和(HO)2SO 2。H2SO3中的S为+4价,而H2SO4中的S为+6价,正电性更高,导致S-O-H中的O的电子更向S偏移,越易电离出H+。 共价键 范德华力或分子间作用力 8
4 CO32-与NO3- H2SO4 H2SO4和H2SO3可表示为(HO)2SO和(HO)2SO 2。H2SO3中的S为+4价,而H2SO4中的S为+6价,正电性更高,导致S-O-H中的O的电子更向S偏移,越易电离出H+。 共价键 范德华力或分子间作用力 8 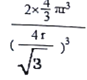
【解析】基态R原子核外有三个能级,每个能级上电子数相同,则R是C;X的双原子单质δ键和π键数目之比为1∶2,X是N;Y是短周期主族元素中,原子半径最大,则的Y是Na;Z的最高正化合价与最低负化合价之和等于4,Z是S;基态E3+的外围电子排布式是3d5,这说明E的原子序数是26,即E是Fe。则
(1)Fe元素在周期表中的位置是第四周期VIII族,其基态原子中电子占据的最高能层是N。(2)元素 X的氢化物M,分子内含18个电子,M的结构式为![]() ,每个中心原子的价层电子对数是4,均有一对孤对电子。(3)原子数和价电子数分别都相等的是等电子体,则在R、X、Z的含氧酸根离子中,互为等电子体的离子组是CO32-与NO3-。(4)由于H2SO4和H2SO3可表示为(HO)2SO和(HO)2SO 2。H2SO3中的S为+4价,而H2SO4中的S为+6价,正电性更高,导致S-O-H中的O的电子更向S偏移,越易电离出H+,因此硫酸的酸性更强。(5)(SN)4在常压下,高于130℃时分解为相应的单质,S和N之间的化学键是共价键,则这一变化破坏的作用力是共价键;在淡黄色→橙黄色→深红色的转化中没有新物质生成,化学键不变,破坏的作用力是范德华力或分子间作用力。(6)常温条件下,铁的晶体采用如图所示的堆积方式。则这种堆积模型的配位数为8。晶胞中铁原子个数是1+8×1/8=2,若Fe原子的半径为r,则体对角线是4r,所以边长是
,每个中心原子的价层电子对数是4,均有一对孤对电子。(3)原子数和价电子数分别都相等的是等电子体,则在R、X、Z的含氧酸根离子中,互为等电子体的离子组是CO32-与NO3-。(4)由于H2SO4和H2SO3可表示为(HO)2SO和(HO)2SO 2。H2SO3中的S为+4价,而H2SO4中的S为+6价,正电性更高,导致S-O-H中的O的电子更向S偏移,越易电离出H+,因此硫酸的酸性更强。(5)(SN)4在常压下,高于130℃时分解为相应的单质,S和N之间的化学键是共价键,则这一变化破坏的作用力是共价键;在淡黄色→橙黄色→深红色的转化中没有新物质生成,化学键不变,破坏的作用力是范德华力或分子间作用力。(6)常温条件下,铁的晶体采用如图所示的堆积方式。则这种堆积模型的配位数为8。晶胞中铁原子个数是1+8×1/8=2,若Fe原子的半径为r,则体对角线是4r,所以边长是![]() ,所以单质Fe的原子空间利用率为
,所以单质Fe的原子空间利用率为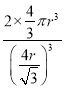 。
。

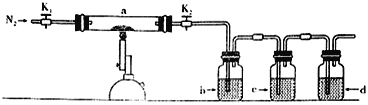
【题目】一名同学把4.48 L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8 mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
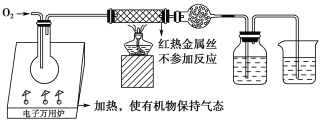
实验结束后发现无水CuSO4变蓝,干燥管和洗气瓶共增重18 g,澄清石灰水变浑浊后又恰好变澄清。请根据实验回答下列问题:
(1)O2要过量的原因是:________________。
(2)若该有机物只含C、H两种元素,且不含任何官能团,也不含脂环,则该有机物的分子式为________,它可能属于________(填序号)。
A.烷烃 B.苯的同系物 C.芳香烃 D.烃的衍生物
该物质可能的结构简式为_____________________。
(3)若该有机物分子中含有一个氧原子,则它可能是哪几类物质?请各举一例,填写在下表中:
物质种类 | 实例(写结构简式) |
_________ | _________ |
_________ | _________ |
_________ | _________ |
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%,质量分数),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO47H2O的工艺流程如下:
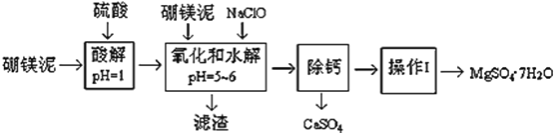
(1)实验中需要1 mol/L的硫酸800 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为__________(填写选项字母)
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有__________________。
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法___________________。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_____________________________。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO47H2O .