题目内容
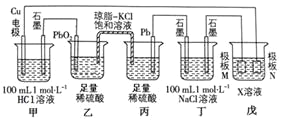
【题目】某小组同学利用下图装置进行电化学实验,相关说法正确的是![]()
![]()
A.乙池中发生的电极反应式为:![]()
B.工作时,盐桥中的![]() 向丙池迁移,
向丙池迁移,![]() 向乙池迁移
向乙池迁移
C.当电路中通过![]() 电子时,甲、丁两池均产生
电子时,甲、丁两池均产生![]() 气体
气体
D.若戊池的目的是在铜材料上镀银,则极板N的材料应选择纯铜
【答案】C
【解析】
根据装置图,乙、丙为构成铅蓄电池,Pb为负极,PbO2为正极,甲、丁、戊为电解池,按照电解原理,甲中石墨为阳极,Cu电极为阴极,丁中左端石墨为阴极,右端石墨为阳极,戊中M为阴极,N为阳极,据此分析;
A. 乙、丙构成电池装置,PbO2为正极,Pb为负极,乙池中发生的电极反应式为:![]() ,故A错误;
,故A错误;
B. 乙是原电池的正极,丙是原电池的负极,根据原电池工作原理,阴离子移向原电池的负极,阳离子移向原电池的正极,即工作时,盐桥中的K+向乙池迁移,![]() 向丙池迁移,故B错误;
向丙池迁移,故B错误;
C. 甲和丁均为电解池,氯离子物质的量均是![]() ,则当电路中通过
,则当电路中通过![]() 电子时,
电子时,![]() 的量不足,会出现两段电解,阳极先产生氯气再生氧气,阴极产生氢气,最终得到氢气是
的量不足,会出现两段电解,阳极先产生氯气再生氧气,阴极产生氢气,最终得到氢气是![]() 、氯气
、氯气![]() 、氧气
、氧气![]() ,甲、丁两池均产生
,甲、丁两池均产生![]() 气体,故C正确;
气体,故C正确;
D. M板是阴极,N板是阳极,若戊池的目的是在铜材料上镀银,则极板N的材料应选择银,故D错误;
答案:C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/LCuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K。
酸液都取足量、相同体积,请你帮助完成下面实验设计表(表中不留空格):
实验编号 | 温度(K) | 盐酸浓度 | 醋酸浓度 | 实验目的 |
① | 298 | 0.20mol/L |
| a.实验①和②是探究_____对锌与盐酸反应速率的影响; b.实验①和③是探究_____对锌与盐酸反应速率的影响; c.实验①和④是探究相同温度下,相同 浓度的盐酸、醋酸与锌反应速率的区别 |
② | 308 | 0.20mol/L |
| |
③ | 298 | 0.40mol/L |
| |
④ | ______ |
| 0.20mol/L |
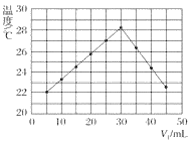
(2)若(1)中实验①锌片消失的时间是20s,则锌片剩余质量与时间关系图如下图:
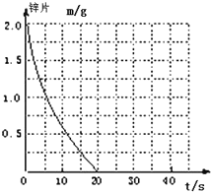
假设:该反应温度每升高10℃,反应速率是原来的2倍;温度相同、浓度相同时,醋酸的平均反应速度是盐酸的1/2.请你在此图中大致画出“实验②”(用实线)、“实验④中醋酸实验”(用虚线)的锌片质量与时间关系曲线.____________________________
(3)某实验小组在做(1)中实验④时误加少量0.10mol/LCuCl2溶液,发现反应速率与(1)中实验①接近,加少量0.10mol/LCuCl2溶液后速率变快的原因是_________________。