题目内容
16.下列反应既符合图象Ⅰ又符合图象Ⅱ的是( )
| A. | N2(g)+3H2(g)?2NH3(g)△H<0 | B. | 2SO3(g)?2SO2(g)+O2(g)△H>0 | ||
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | D. | C(s)+H2O(g)?H2(g)+CO(g)△H>0 |
分析 根据图象Ⅰ可知,温度高,平衡时生成物浓度越高,说明升温平衡正向移动;由图象Ⅱ得出,达平衡后,压强越大,逆反应速率大于正反应速率,即向逆反应方向移动,说明该反应为气体体积增大的反应,据此分析.
解答 解:由图象Ⅰ可知,温度高,平衡时生成物浓度越高,说明升温平衡正向移动,即该反应为吸热反应;由图象Ⅱ得出,达平衡后,压强越大,逆反应速率大于正反应速率,即向逆反应方向移动,说明该反应为气体体积增大的反应,所以符合条件的反应应该为气体体积增大的吸热反应,则AC错误,BD正确;
故选:BD.
点评 本题结合图象考查化学平衡的影响因素分析,掌握平衡移动原理是解题关键,题目难度中等.

练习册系列答案
相关题目
6.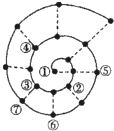 如果将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状.图中每个“•”代表一种元素,其中①代表氢元素.下列说法不正确的是( )
如果将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状.图中每个“•”代表一种元素,其中①代表氢元素.下列说法不正确的是( )
 如果将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状.图中每个“•”代表一种元素,其中①代表氢元素.下列说法不正确的是( )
如果将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状.图中每个“•”代表一种元素,其中①代表氢元素.下列说法不正确的是( )| A. | ①~⑦所代表的元素中,共有2种金属元素,5种非金属元素 | |
| B. | ③④⑤代表的元素所形成的化合物中,某些化合物可使酸性高锰酸钾溶液褪色 | |
| C. | ①~⑦所代表的元素中,元素④所形成的简单离子半径最大 | |
| D. | 气态氢化物的沸点及稳定性元素④比⑦好 |
7. 某温度下,在体积为1L的密闭容器中,存在如下关系:xHF(g)?(HF)x(g),反应物和生成物的物质的量随时间变化关系如图.下列说法错误的是( )
某温度下,在体积为1L的密闭容器中,存在如下关系:xHF(g)?(HF)x(g),反应物和生成物的物质的量随时间变化关系如图.下列说法错误的是( )
 某温度下,在体积为1L的密闭容器中,存在如下关系:xHF(g)?(HF)x(g),反应物和生成物的物质的量随时间变化关系如图.下列说法错误的是( )
某温度下,在体积为1L的密闭容器中,存在如下关系:xHF(g)?(HF)x(g),反应物和生成物的物质的量随时间变化关系如图.下列说法错误的是( )| A. | x=2 | |
| B. | 平衡时混合气体的平均摩尔质量是23.3g/mol | |
| C. | 该温度下,反应的平衡常数为0.25 L•mol-1 | |
| D. | t1时刻,保持恒温恒容,再充入1mol HF(g),重新达到平衡时,$\frac{c[(HF)_{x}]}{c(HF)}$增大 |
11.下列做法不利于“开源节流”的是( )
| A. | 开发太阳能、水能、风能、地热能等新能源 | |
| B. | 大力开采煤、石油和天然气,以满足人们日益增长的能源需求 | |
| C. | 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源 | |
| D. | 减少资源消耗,注重资源的重复使用、资源的循环再生 |
1.分类是化学学习和研究的常用方法之一.下列物质的分类正确的是( )
| A. | 生石灰是氧化物 | B. | 甲烷属于电解质 | C. | 纯碱属于碱 | D. | 铝是常用氧化剂 |
8.a g KNO3溶于b g水,形成V mL饱和溶液.下列关系式错误的是( )
| A. | KNO3物质的量浓度:c(KNO3)=$\frac{a}{101V}$mol•L-1 | |
| B. | 20℃时KNO3的溶解度S=$\frac{100a}{b}$ g | |
| C. | KNO3质量分数:w(KNO3)=$\frac{100a}{a+b}$% | |
| D. | 该溶液的密度ρ=$\frac{1000(a+b)}{V}$g•L-1 |
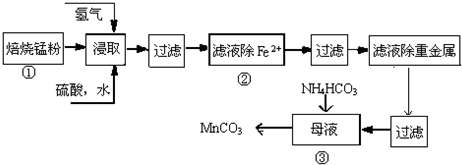
17.锌锰废电池可回收锌、锰元素生产硫酸锌及碳酸锰,其中生产碳酸锰的主要工艺如下:
试回答下列问题:
(1)硫酸锌水溶液显酸性,用离子方程式说明Zn2++2H2O?Zn(OH)2+2H+.
(2)原料锰粉粗品中主要成分为MnO2和炭,在过程①焙烧时反应的化学方程式为MnO2+C═MnO+CO↑,该反应的氧化产物是CO,每生成44.8L(标准状况下)气体时转移电子数为4NA.
(3)在50~55℃时向过程③中MnSO4的母液中加入足量NH4HCO3,有气体生成,其化学方程式为:MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+H2O+CO2↑.
(4)已知三种离子沉淀的pH范围为Fe3+:2.7~3.7. Mn2+:8.6~10.1,Fe2+:7.6~9.6.下表是上述过程②中除去Fe2+的模拟操作方法,请完成下表内容:

试回答下列问题:
(1)硫酸锌水溶液显酸性,用离子方程式说明Zn2++2H2O?Zn(OH)2+2H+.
(2)原料锰粉粗品中主要成分为MnO2和炭,在过程①焙烧时反应的化学方程式为MnO2+C═MnO+CO↑,该反应的氧化产物是CO,每生成44.8L(标准状况下)气体时转移电子数为4NA.
(3)在50~55℃时向过程③中MnSO4的母液中加入足量NH4HCO3,有气体生成,其化学方程式为:MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+H2O+CO2↑.
(4)已知三种离子沉淀的pH范围为Fe3+:2.7~3.7. Mn2+:8.6~10.1,Fe2+:7.6~9.6.下表是上述过程②中除去Fe2+的模拟操作方法,请完成下表内容:
| 实验操作 | 离子方程式 |
| 步骤1:取少量滤液于试管中,加入过量酸化的H2O2溶液,振荡. | 2Fe2++H2O2+2H+=2Fe3++2H2O |
| 步骤2:将pH调到3.7~8.6,使Fe3+沉淀完全. | Fe3++3H2O?Fe(OH)3+3H+ |
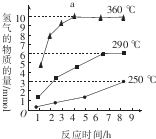 氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.
氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.