题目内容
17.0.1mol某有机物完全燃烧后生成0.3mol C02,同质量的该有机物与足量的金属钠反应生成0.1mol H2,该有机物可能是 ( )| A. | 丙三醇 | B. | 1,2-丙二醇 | C. | 1,3-丙二醇 | D. | 乙二醇 |
分析 0.1mol某有机物完全燃烧后生成0.3mol C02,说明含有3个C原子,结合反应的关系式2R-OH+2Na→2R-ONa+H2↑计算.
解答 解:0.1mol某有机物完全燃烧后生成0.3mol C02,说明含有3个C原子,醇与钠反应的关系式为2R-OH+2Na→2R-ONa+H2↑,同质量的该有机物与足量的金属钠反应生成0.1mol H2,说明有机物含有2个羟基,即含有3个C原子,含有2个羟基,则应为1,2-丙二醇或1,3-丙二醇,
故选BC.
点评 本题考查有机物的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握醇与钠反应的特征,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,28g C2H4和C3H6的混合物中含有2nA个C原子 | |
| B. | 1 mol Fe与足量稀HNO3反应,转移个2nA个电子 | |
| C. | 1L 0.1 mol/L NaHCO3溶液中含有0.1nA个HCO3- | |
| D. | 常温常压下,22.4L的NO2和CO2混合气体含有2nA个O原子 |
5.下列每组中的两对物质,都能用分液漏斗分离且油层由分液漏斗上口倒出的是( )
| A. | 汽油和水,四氯化碳和水 | B. | 汽油和水,苯和水 | ||
| C. | 食用油和水,醋酸和水 | D. | 葡萄糖和水,酒精和水 |
12.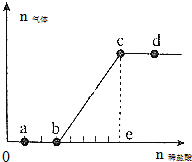 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.下列有关说法中正确的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.下列有关说法中正确的是( )
 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.下列有关说法中正确的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.下列有关说法中正确的是( )| A. | a点对应的溶液中c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$) | |
| B. | b,c段反应的离子方程式为HCO${\;}_{3}^{-}$+H+═H2O+CO2↑ | |
| C. | 原溶液中n(NaCO3)=n(NaHCO3) | |
| D. | K+、NO${\;}_{3}^{-}$、SiO${\;}_{3}^{2-}$可大量存在于d点对应的溶液中 |
9.在0.1L某浓度的NaCl溶液中含有0.8mol Na+,下列对该溶液的说法中,不正确的是( )
| A. | 量取10mL该溶液倒入试管中,试管中,试管中Na+的物质的量为0.08mol | |
| B. | 该溶液的物质的量浓度为0.8mol•L-1 | |
| C. | 该溶液中含有46.8g NaCl | |
| D. | 配置50mL该溶液需用23.4g NaCl |
15.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:H2S+Na2CO3═NaHS+NaHCO3.
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)的△H=-246.4kJ•mol-1;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是ce(填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正> v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol/L.
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:H2S+Na2CO3═NaHS+NaHCO3.
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)的△H=-246.4kJ•mol-1;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是ce(填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol/L.
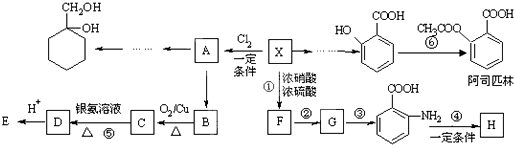
 Ⅱ
Ⅱ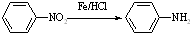 (苯胺,易被氧化)
(苯胺,易被氧化)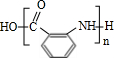 ;
;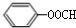 +2NaOH→
+2NaOH→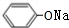 +HCOONa+H2O.
+HCOONa+H2O.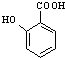 有多种同分异构体,其中含符合下列条件的共有2种.
有多种同分异构体,其中含符合下列条件的共有2种.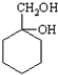 的过程.
的过程.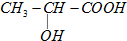 )及其盐广泛应用于食品、医药、化工等领域.有一种制备乳酸方法如下:
)及其盐广泛应用于食品、医药、化工等领域.有一种制备乳酸方法如下: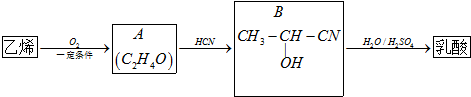
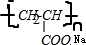 .
.