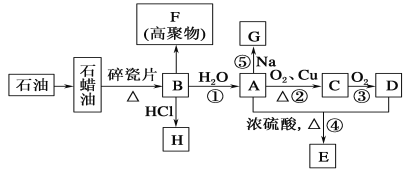
题目内容
【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景,可用Pt/Al2O3、Pd/C、 Rh/SiO2等作催化剂,采用如下反应来合成甲醇:2H2 (g)+CO(g)CH3OH(g)
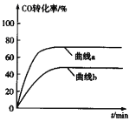
(1)下表所列数据是各化学键的键能,该反应的ΔH=_______(用含字母的代数式表示)。
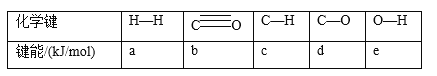
(2)某科研小组用Pd/C作催化剂,在450℃时,研究了n(H):n(CO)分别为2:1、3:1时CO转化率的变化情况(如图),则图中表示n(H2):n(CO)=3:1的变化曲线为______(填“曲线a"或“曲线b”)。
(3)某化学研究性学习小组模拟工业合成甲醇的反应,在2L的恒容密闭容器内充入1 mol CO和2molH2,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
则从反应开始到20min时,CO的平均反应速率为________,该温度下的平衡常数K为_______.
(4)将CO和H2加入密闭容器中,在一定条件下发生反应:CO(g)+2H2(g) CH3OH(g) ΔH<0。平衡时CO的体积分数(%)与温度和压强的关系如下图所示(虚线框表示没有测定该条件下的数据)。
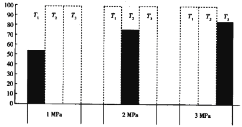
T1、T2、T3由大到小的关系是_________,判断理由是____________
(5)美国的两家公司合作开发了多孔硅甲醇直接燃料电池,其工作原理如图
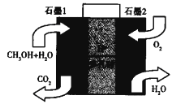
①石墨2为__________ (填“正“或“负“)极。
②石墨1极发生的电极反应式为________
【答案】(2a+b-3c-d-e)kJ·mol-1 曲线a 0.0125mol·L-1·min-1 4 T3>T2>T1 压强越大,CO的体积分数越小,T1、T2、T3对应的CO的体积分数逐渐增大,该反应向左移动,则T3>T2>T1 正 CH3OH+H2O-6e-=CO2↑+6H+
【解析】
(1)反应热ΔH=反应物的键能和生成物键能和;
(2)n(H2):n(CO)越大,CO的转化率越大;
(3)反应进行到20min时达到平衡,在恒温恒容容器中压强与气体的物质的量成正比,起始时总物质的量为3mol,压强为12.6MPa,平衡时压强为8.4MPa,则平衡时总物质的量为3mol![]() =2mol,设反应中参加反应的CO的物质的量为xmol,则:
=2mol,设反应中参加反应的CO的物质的量为xmol,则:
2H2 (g)+CO(g)CH3OH(g)
起始物质的量(mol) 2 1 0
变化物质的量(mol) 2x x x
平衡物质的量(mol) 2-2x 1-x x
故(2-2x)+(1-x )+x=2,解得x=0.5,再根据速率公式和平衡常数表达式计算即可;
(4)图示中压强越大,CO的体积分数越小,且CO(g)+2H2(g) ≒CH3OH(g) ΔH<0温度升高平衡逆向移动,CO的体积分数越大;
(5)由甲醇燃料电池工作原理可知,石墨2通入O2,发生还原反应生成H2O,而原电池的正极发生还原反应,则石墨1为原电池的负极,发生氧化反应,甲醇被氧化生成CO2;
(1)已知反应热ΔH=反应物的键能和-生成物键能和,则2H2 (g)+CO(g)CH3OH(g)的反应热ΔH=(2a+b)kJ/mol-(3c+d+e)kJ/mol=(2a+b-3c-d-e)kJ·mol-1;
(2)n(H2):n(CO)越大,CO的转化率越大,故曲线a表示n(H2):n(CO)=3:1的变化曲线;
(3)反应进行到20min时达到平衡,在恒温恒容容器中压强与气体的物质的量成正比,起始时总物质的量为3mol,压强为12.6MPa,平衡时压强为8.4MPa,则平衡时总物质的量为3mol![]() =2mol,设反应中参加反应的CO的物质的量为xmol,则:
=2mol,设反应中参加反应的CO的物质的量为xmol,则:
2H2 (g)+CO(g)CH3OH(g)
起始物质的量(mol) 2 1 0
变化物质的量(mol) 2x x x
平衡物质的量(mol) 2-2x 1-x x
故(2-2x)+(1-x )+x=2,解得x=0.5,
则从反应开始到20min时,CO的平均反应速率为 =0.0125mol·L-1·min-1;
=0.0125mol·L-1·min-1;
该温度下的平衡常数K=![]() =
=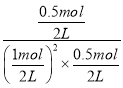 =4;
=4;
(4)已知CO(g)+2H2(g) CH3OH(g) ΔH<0,平衡时温度升高平衡逆向移动,CO的体积分数增大,由图示可知压强越大,CO的体积分数越小,T1、T2、T3对应的CO的体积分数逐渐增大,该反应向左移动,则T3>T2>T1;
(5)①石墨2通入O2,发生还原反应生成H2O,而原电池的正极发生还原反应,则石墨2为正极;
②石墨1为燃料电池的负极,甲醇被氧化生成CO2,发生的电极反应式为CH3OH+H2O-6e-=CO2↑+6H+。

 阅读快车系列答案
阅读快车系列答案【题目】一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 2 | 4 | 6 | 8 |
n(SO3) / mol | 0 | 0. 8 | 1. 4 | 1.8 | 1.8 |
下列说法正确的是
A. 反应在前2 s 的平均速率v(O2) = 0. 4 mol·L-1·s-1
B. 保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C. 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10%
D. 保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)增大