题目内容
6.如图为H2与O2反应生成H2O(g)的能量变化示意图:下列有关叙述不正确的是( )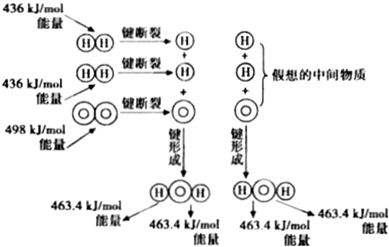
| A. | 1molH2分子断键需要吸收436kJ的能量 | |
| B. | H2(g)+$\frac{1}{2}{O}_{2}$(g)═H2O(g)△H=-241.8kJ/mol | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 形成化学键释放的总能量比断裂化学键吸收的总能量小 |
分析 A、化学键断裂需要吸收能量;
B、反应焓变=反应物总键能-生成物总键能,标注物质聚集状态和对应反应焓变写出热化学方程式;
C、反应是放热反应,结合能量守恒分析;
D、反应为放热反应,形成化学键放出能量高于断裂化学键吸收能量;
解答 解:A、化学键断裂需要吸收能量,1molH2分子断键需要吸收436kJ的能量,故A正确;
B、H2(g)+$\frac{1}{2}{O}_{2}$(g)═H2O(g)反应焓变=反应物总键能-生成物总键能=(436+$\frac{1}{2}$×498-2×463.4)=-241.8kJ/mol,标注物质聚集状态和对应反应焓变写出热化学方程式为,H2(g)+$\frac{1}{2}{O}_{2}$(g)═H2O(g)△H=-241.8kJ/mol,故B正确;
C、反应是放热反应,结合能量守恒分析反应物的总能量高于生成物的总能量,故C正确;
D、反应为放热反应,依据能量守恒可知,形成化学键放出能量高于断裂化学键吸收能量反应才是放热反应,故D错误;
故选D.
点评 本题考查了反应焓变的分析判断,热化学方程式的计算应用,注意化学反应实质的理解应用,键能计算反应焓变的方法,题目难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
17.下列说法正确的是( )
| A. | 糖类、油脂、蛋白质都是由C、H、O三种元素组成的 | |
| B. | 糖类、油脂、蛋白质都是高分子化合物 | |
| C. | 糖类、油脂、蛋白质都能发生水解反应 | |
| D. | 油脂有油和脂肪之分,都属于酯类 |
14.运用化学反应原理知识回答下列有关碳和碳的化合物的问题:
(1)汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应的△H<0). 在2L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
①请结合上表数据,写出NO与CO反应的化学方程式2CO+2NO═N2+2CO2.
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,根据表中数据计算K1=3200L/mol(或3200).根据表中数据判断,温度T1和T2的关系是(填序号)A.
A.T1>T2B.T1<T2 C.T1=T2 D.无法比较
(2)反应生成的气体E经常用氢氧化钠溶液来吸收,现有0.4molE,若用200mL 3mol/L NaOH溶液将其完全吸收,则溶液中离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(3)常温下,向(2)所得的混合溶液中,滴加盐酸至中性时,溶质的主要成分有NaCl、NaHCO3、H2CO3或CO2.
(4)已知CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,工业上利用天然气(主要成分是CH4)与CO2进行高温重整制备CO和H2,写出该反应的热化学方程式:CH4(g)+CO2(g)═2CO(g)+H2(g)△H=+247.3kJ•mol-1.
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有较高的发电效率,因而受到特别重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO为负极燃气,空气与CO2 的混合气为正极助燃气,制得在 650℃下工作的燃料电池,请写出其负极的电极式:2CO-4e-+2CO32-=4CO2.
(1)汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应的△H<0). 在2L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
物质 T/℃n/mol | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,根据表中数据计算K1=3200L/mol(或3200).根据表中数据判断,温度T1和T2的关系是(填序号)A.
A.T1>T2B.T1<T2 C.T1=T2 D.无法比较
(2)反应生成的气体E经常用氢氧化钠溶液来吸收,现有0.4molE,若用200mL 3mol/L NaOH溶液将其完全吸收,则溶液中离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(3)常温下,向(2)所得的混合溶液中,滴加盐酸至中性时,溶质的主要成分有NaCl、NaHCO3、H2CO3或CO2.
(4)已知CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,工业上利用天然气(主要成分是CH4)与CO2进行高温重整制备CO和H2,写出该反应的热化学方程式:CH4(g)+CO2(g)═2CO(g)+H2(g)△H=+247.3kJ•mol-1.
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有较高的发电效率,因而受到特别重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO为负极燃气,空气与CO2 的混合气为正极助燃气,制得在 650℃下工作的燃料电池,请写出其负极的电极式:2CO-4e-+2CO32-=4CO2.
1.200℃、101kPa时,在密闭容器中充入1molH2和1molI2,发生反应I2(g)+H2(g)?2HI(g)△H=-14.9kJ/mol.反应一段时间后,能说明反应已经达到化学平衡状态的是( )
| A. | 放出的热量小于14.9kJ | |
| B. | 反应容器内压强不再变化 | |
| C. | HI生成的速率与HI分解的速率相等 | |
| D. | 单位时间内消耗amolH2,同时生成2amolHI |
4.使蛋白质从水溶液中析出而又不变性,以下方法可行的是( )
| A. | 过滤 | B. | 加入CuSO4溶液 | C. | 加入饱和食盐水 | D. | 分液 |
5.下列说法中不正确的是( )
| A. | 气体单质中,一定有δ键,可能有π键 | |
| B. | δ键比π键重叠程度大,形成的共价键强 | |
| C. | 两个原子间形成共价键时,最多有一个δ键 | |
| D. | N2分子有一个δ键,两个π键 |
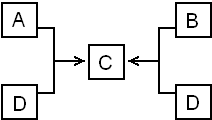 已知A与盐酸反应生成B和氢气.根据右图回答下列问题:
已知A与盐酸反应生成B和氢气.根据右图回答下列问题: ;C的化学式为NaAlO2;B+D→C的离子方程式为Al3++4OH-=2AlO2-+2H2O.
;C的化学式为NaAlO2;B+D→C的离子方程式为Al3++4OH-=2AlO2-+2H2O. 请回答:
请回答: 2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法.其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子.如C2H6离子化后可得到C2H6+、C2H5+、C2H4+…,然后测定其质荷比.某有机物样品的质荷比如下图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )
2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法.其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子.如C2H6离子化后可得到C2H6+、C2H5+、C2H4+…,然后测定其质荷比.某有机物样品的质荷比如下图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )