��Ŀ����
14�����û�ѧ��Ӧԭ��֪ʶ�ش������й�̼��̼�Ļ���������⣺��1������β������Ҫ��Ⱦ����NO�Լ�ȼ��ȼ�ղ���ȫ��������CO���������ִ������е���Ҫ������Ⱦ�Ϊ�˼�������β����ɵĴ�����Ⱦ�����ǿ�ʼ̽������NO��CO��һ��������ת��Ϊ����������E��F�ķ�������֪�÷�Ӧ�ġ�H��0���� ��2L�ܱ������м���һ����NO��CO�����¶ȷֱ���T1��T2ʱ����ø�����ƽ��ʱ���ʵ������±���
���� T/��n/mol | NO | CO | E | F |
| ��ʼ | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
��������ӦT1��ʱ��ƽ�ⳣ��ΪK1��T2��ʱ��ƽ�ⳣ��ΪK2�����ݱ������ݼ���K1=3200L/mol����3200�������ݱ��������жϣ��¶�T1��T2�Ĺ�ϵ�ǣ�����ţ�A��
A��T1��T2B��T1��T2 C��T1=T2 D�����Ƚ�
��2����Ӧ���ɵ�����E����������������Һ�����գ�����0.4molE������200mL 3mol/L NaOH��Һ������ȫ���գ�����Һ������Ũ���ɴ�С��˳��Ϊ��c��Na+����c��HCO3-����c��CO32-����c��OH-����c��H+����
��3�������£���2�����õĻ����Һ�У��μ�����������ʱ�����ʵ���Ҫ�ɷ���NaCl��NaHCO3��H2CO3��CO2��
��4����֪CH4��H2��CO��ȼ���ȷֱ�Ϊ890.3kJ/mol��285.8kJ/mol��283.0kJ/mol����ҵ��������Ȼ������Ҫ�ɷ���CH4����CO2���и��������Ʊ�CO��H2��д���÷�Ӧ���Ȼ�ѧ����ʽ��CH4��g��+CO2��g���T2CO��g��+H2��g����H=+247.3kJ•mol-1��
��5��CO����������ȼ�ϵ�ص�ȼ�ϣ�ij������ȼ�ϵ�ؾ��нϸߵķ���Ч�ʣ�����ܵ��ر����ӣ��õ���� Li2CO3 �� Na2CO3 �������λ����������ʣ�COΪ����ȼ����������CO2 �Ļ����Ϊ������ȼ�����Ƶ��� 650���¹�����ȼ�ϵ�أ���д���为���ĵ缫ʽ��2CO-4e-+2CO32-=4CO2��
���� ��1�����ɱ������ݿ�֪��CO��NO��E��F�Ļ�ѧ������֮��Ϊ0.08��0.08��0.08��0.04=2��2��2��1����Ӧ��C�����������ԭ���غ��֪������ΪN2��CO2��
�ڼ���������ƽ��Ũ�ȣ�����ƽ�ⳣ������ʽ���㣻�ɱ������ݿ�֪���¶���T1��ΪT2��ƽ��������Ӧ�ƶ�����������Ӧ�Ƿ��ȣ��¶Ƚ���ƽ������ȷ�Ӧ������У�
��2�����ݶ�����̼����������֮�䷴Ӧ���Ĺ�ϵ������1��1��Ӧ��������̼�����ƣ�����1��2��Ӧ��������̼�����������ش�
��3����Һ���ܽ��ж�����̼��̼�
��4��CH4��H2����CO��ȼ���ȷֱ�д��ȼ�յ��Ȼ�ѧ����ʽ�����ø�˹������д�÷�Ӧ���Ȼ�ѧ����ʽ��
��5��ȼ�ϵ���У�ͨ��CO��һ��Ϊԭ��صĸ���������������Ӧ���缫��ӦʽΪ2CO-4e-+2CO32-=4CO2��ͨ��������CO2�Ļ������һ��Ϊԭ��ص�������������ԭ��Ӧ���缫��ӦʽΪO2+4e-+2CO2=2CO32-��
��� �⣺��1�����ɱ������ݿ�֪��CO��NO��E��F�Ļ�ѧ������֮��Ϊ0.08��0.08��0.08��0.04=2��2��2��1����Ӧ��C�����������ԭ���غ��֪������ΪN2��CO2���Ҹ÷�ӦΪ���淴Ӧ���ʷ�Ӧ����ʽΪ��2CO+2NO?2CO2+N2��
�ʴ�Ϊ��2CO+2NO?2CO2+N2��
�ڴӱ������ݿ�֪T1��ʱ��ƽ��Ũ��c��CO��=��NO��=$\frac{0.02mol}{2L}$=0.01mol/L��c��N2��=$\frac{0.04mol}{2L}$=0.02mol/L��c��CO2��=$\frac{0.08mol}{2L}$=0.04mol/L����T1��ʱ�÷�Ӧ��ƽ�ⳣ��ΪK1=$\frac{��0.04mol/L��^{2}��0.02mol/L}{��0.01mol/L��{\;}^{2}��0.01mol/L��{\;}^{2}}$=3200���������ݿ�֪���¶���T1��ΪT2��ƽ��������Ӧ�ƶ�����������Ӧ�Ƿ��ȷ�Ӧ��˵��T1��T2��
�ʴ�Ϊ��3200��A��
��2�����ݶ�����̼����������֮�䷴Ӧ���Ĺ�ϵ������1��1��Ӧ��������̼�����ƣ�����1��2��Ӧ��������̼���ƣ�0.4molCO2��200mL 3mol/L NaOH��Һ��ϣ����ߵ����ʵ���֮����2��3��������Һ��̼���ƺ�̼�����ƵĻ���������Լ���c��OH-����c��H+����̼�������ˮ��̶ȴ���̼��������ӵ�ˮ��̶ȣ�����c��CO32-����c��HCO3-������c��Na+����c��HCO3-����c��CO32-����c��OH-����c��H+����
�ʴ�Ϊ��c��Na+����c��HCO3-����c��CO32-����c��OH-����c��H+����
��3�����������ᷴӦ�����Ȼ��ƣ���Һ���ܽ��ж�����̼��̼�ᣬ��Ӧ����NaHCO3���ʴ�Ϊ��NaCl��NaHCO3��H2CO3��CO2��
��4������CH4��H2����CO��ȼ���ȷֱ�д��ȼ�յ��Ȼ�ѧ����ʽ��
��O2��g��+2H2��g��=2H2O��L����H=-571.6kJ•mol -1��
��CH4��g��+2O2��g��=CO2��g��+2H2O��L����H=-890.3kJ•mol-1��
��2CO��g��+O2��g��=2CO2��g����H=-566.03kJ•mol-1��
���ø�˹���ɽ���-��-�ۿɵã�CH4��g��+CO2��g��=2CO��g��+2H2��g����H=+247.3 kJ•mol -1��
�ʴ�Ϊ��CH4��g��+CO2��g��=2CO��g��+2H2��g����H=+247.3 kJ•mol -1��
��5��ȼ�ϵ���У�ͨ��CO��һ��Ϊԭ��صĸ���������������Ӧ���缫��ӦʽΪ2CO-4e-+2CO32-=4CO2��ͨ��������CO2�Ļ������һ��Ϊԭ��ص�������������ԭ��Ӧ���缫��ӦʽΪO2+4e-+2CO2=2CO32-��ԭ��ص缫��Ӧ�������ϵĵ缫��ӦʽΪO2+4e-+2CO2=2CO32-�������ϵĵ缫��ӦʽΪ2CO-4e-+2CO32-=4CO2��
�ʴ�Ϊ��2CO-4e-+2CO32-=4CO2��O2+4e-+2CO2=2CO32-��
���� ���⿼�鷴Ӧ���ʡ���ѧƽ�ⳣ����ƽ���ƶ�ԭ��������ԭ�����Ȼ�ѧ����ʽ��˹���ɷ�������Ӧ�ã�ע�ⷴӦ����ķ����жϺ͵缫��Ӧʽ����ȷ��д�����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�

| A�� | c��Cl-����c��NH4+����c��H+����c��OH-�� | B�� | c��Cl-����c��H+����c��NH4+����c��OH-�� | ||
| C�� | c��NH4+����c��Cl-����c��OH-����c��H+�� | D�� | c��OH-����c��H+����c��Cl-����c��NH4+�� |
| A�� | ��ϩ�ı���ģ�ͣ� | |
| B�� | ���ĵ���ʽ�� | |
| C�� | �Ҵ��ķ���ʽC2H6O | |
| D�� | ������Ϊ53��������Ϊ78�ĵ�ԭ�ӣ�${\;}_{53}^{131}$I |
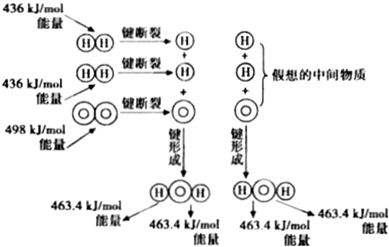
| A�� | 1molH2���Ӷϼ���Ҫ����436kJ������ | |
| B�� | H2��g��+$\frac{1}{2}{O}_{2}$��g���TH2O��g����H=-241.8kJ/mol | |
| C�� | ��Ӧ�������������������������� | |
| D�� | �γɻ�ѧ���ͷŵ��������ȶ��ѻ�ѧ�����յ�������С |
| A�� | ȷ����һ�������ĺ�ɫ��ĩ����H2��ֻ�ԭ�����ø�����ռ����õ�ˮ�����ˮ��ȷ���������м��� | |
| B�� | ȷ����һ�������ĺ�ɫ��ĩ���ܽ����������ᣬ����������Һ���ڿ������������������䣬�������÷�ĩ���������м��㣮 | |
| C�� | ȷ����һ�������ĺ�ɫ��ĩ����CO��ֻ�ԭ����CO��������ȴ��ȷ����ʣ���������������㣮 | |
| D�� | ȷ����һ�������ĺ�ɫ��ĩ����һ���������ۻ�Ϻ��ȼ����ַ�Ӧ����ȴ��ȷ����ʣ��������������м��� |




