题目内容
6.已知298K时,2SO2(g)+O2(g)?2SO3(g)△H=-197kJ•mol-1.在该温度下,向某密闭恒定体积的容器中通入2mol SO2和1mol O2达到平衡时,SO3为0.6mol,如果此时移走1mol SO2和0.5mol O2,在相同温度下再达到平衡时SO3的物质的量是( )| A. | 0.3mol | B. | 小于0.3mol | ||
| C. | 大于0.3mol,小于0.6mol | D. | 大于0.6mol |
分析 反应为可逆反应,浓度不同,平衡转化的程度不等,根据平衡移动分析判断.
解答 解:向某密闭恒定体积的容器中通入2mol SO2和1mol O2达到平衡时,SO3为0.6mol,
如果此时移走1mol SO2和0.5mol O2,剩余1mol SO2和0.5mol O2,则体系压强比加入2mol SO2和1molO2要小,相当于减小压强,所以平衡会向左移动,所以达到平衡时,SO3的物质的量<$\frac{1}{2}$×0.6mol=0.3mol,
故选B.
点评 本题考查平衡移动原理,题目难度中等,本题注意压强对平衡的影响.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
16.质量分数为a%,物质的量浓度为c1mol/L的稀硫酸蒸发水后,其质量分数变为2a%,此时物质的量浓度为c2mol/L,则c1与c2的关系为( )
| A. | c2=2c1 | B. | c2<2c1 | C. | c2>2c1 | D. | c1=2c2 |
17.能正确表示下列反应的离子方程式是( )
| A. | 向AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| B. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ | |
| C. | 向Ca(ClO)2溶液中通入过量二氧化碳气体:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | |
| D. | 用HF刻蚀玻璃:SiO2+4H++4F-=SiF4↑+2H2O |
14.下列关于有机物的说法不正确的是( )
①C3H6和C2H4的最简式相同且分子量相差14,所以是同系物
②乙二醇和甲醇含有相同的官能团,所以是同系物
③互为同分异构体的化合物不可能具有相同的结构简式
④苯酚、乙酸乙酯、甲醛的沸点逐渐变低.
①C3H6和C2H4的最简式相同且分子量相差14,所以是同系物
②乙二醇和甲醇含有相同的官能团,所以是同系物
③互为同分异构体的化合物不可能具有相同的结构简式
④苯酚、乙酸乙酯、甲醛的沸点逐渐变低.
| A. | ①② | B. | ②④ | C. | ①③ | D. | ③④ |
18.下列电离方程式的书写不正确的是( )
| A. | NH3•H2O═NH$\stackrel{+}{4}$+OH- | B. | BaSO4═Ba2++SO$\stackrel{2-}{4}$ | ||
| C. | HNO3═H++NO$\overline{3}$ | D. | NaOH═Na++OH- |
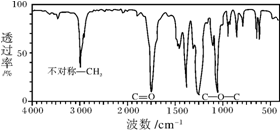 如图是一种分子式为C4H8O2的有机物的红外光谱图,则该有机物的结构简式为CH3COOCH2CH3或是CH3CH2COOCH3(写一种即可),写出其在碱性条件下的水解反应式:CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH.
如图是一种分子式为C4H8O2的有机物的红外光谱图,则该有机物的结构简式为CH3COOCH2CH3或是CH3CH2COOCH3(写一种即可),写出其在碱性条件下的水解反应式:CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH. 恒温恒容时,NO2和N2O4之间发生反应N2O4(g)?2NO2(g),如图所示.
恒温恒容时,NO2和N2O4之间发生反应N2O4(g)?2NO2(g),如图所示.