题目内容
1.下列说法正确的是( )| A. | 棉、麻、羊毛、丝绸等天然衣着材料越来越受人们欢迎,它们的主要成分均为纤维素 | |
| B. | 晶体硅常用作太阳能电池板,它的工作原理符合电池原理 | |
| C. | 高炉炼铁、水泥工业、玻璃工业、海水制镁工业中都需要用到原料碳酸钙 | |
| D. | 雾霾中的PM2.5表面积大,分散在空气中形成胶体,吸附大量有毒有害物质,对人体造成严重危害 |
分析 A.羊毛、丝绸的成分是蛋白质;
B.太阳能电池板是半导体光电转换;
C.石灰石的主要成分是碳酸钙,高温下碳酸钙和二氧化硅能发生化学反应,生产玻璃的原料是纯碱、石灰石和石英,生产水泥以黏土和石灰石为主要原料;
D.胶体粒子的直径介于1nm~100nm之间.
解答 解:A.棉、麻的主要成分均为纤维素;羊毛、丝绸的成分是蛋白质,故A错误;
B.太阳能电池板是半导体光电转换,不是原电池原理,故B错误;
C.生产玻璃的原料是纯碱、石灰石和石英;生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥;石灰石还是高炉炼铁的一种原料(造渣材料),从海水中提取镁的原料:用石灰石可以制得氧化钙进而得到石灰乳,海水,必需用到石灰石,都用到的原料是石灰石,故C正确;
D.胶体粒子的直径介于1nm~100nm之间,PM2.5是指大气中直径≤2.5×10-6m的颗粒物,不一定为胶体,故D错误.
故选C.
点评 本题考查较为综合,为高考常见题型,侧重于化学与生活的考查,有利于培养学习的良好的科学素养,提高学习的积极性,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
11.下列电子式正确的是( )
| A. | H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| B. | Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H]- | |
| C. | ${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{C}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ | |
| D. | 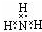 |
9.现有六种元素,其中A、B、C、D为短周期主族元素,EF为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)A的基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(2)E的基态原子核外电子排布式为1s22s22p63s23p63d54s1.
| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的主族序数与周期数的差为4,且不与A元素在同一周期 |
| E是第四周期中含未成对电子数最多的元素 |
| F基态原子外围电子排布式为(n+1)d3n(n+2)Sn |
(2)E的基态原子核外电子排布式为1s22s22p63s23p63d54s1.
16.C60Si60是一种具有C60和Si60结构的新分子,即把“足球型”的C60置于“足球型”Si60内,Si原子与C原子以共价键结合,合成“二重构造”球形分子C60Si60的化学反应类似于( )
| A. | 乙烯制聚乙烯 | B. | 乙酸与乙醇制乙酸乙酯 | ||
| C. | 乙醇制乙醛 | D. | 苯酚与甲醛制酚醛树脂 |
17.下列事实中,不能作为元素金属性和非金属性强弱判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断钠和镁的金属性强弱 | |
| B. | 铁投入CuSO4溶液中置换出铜,判断铜与铁的金属性强弱 | |
| C. | 酸性H2CO3<HCl,判断氯与碳的非金属性强 | |
| D. | F2与Cl2分别与足量的H2反应的难易,判断氟与氯的非金属性强弱 |

 )有还原性,易被氧化;
)有还原性,易被氧化; .
.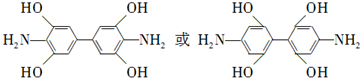 .
. )是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
)是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下: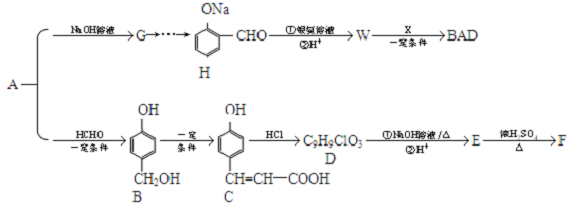
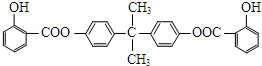
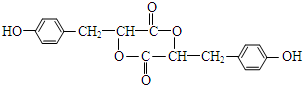
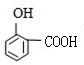 .
.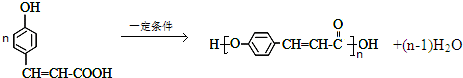 .
. .
.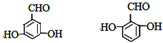 (其中一种).
(其中一种). .
. ,Y的结构式为
,Y的结构式为 .
.