题目内容
无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。实验室用如下装置制备少量无水氯化铝,其反应原理为: 2Al+ 6HCl(g) → 2A1Cl3 + 3H2。
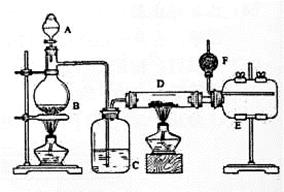
完成下列填空:
(1)写出烧瓶中(B处)发生反应的化学方程式:_____________
(2)C中盛有的试剂为_____。进行实验时应先点燃_____(选填“B”或“D”)处酒精灯。
(3)用粗短导管连接D、E的目的是_______ (选填序号)。
a.防堵塞 b.防倒吸 c.平衡气压 d.冷凝回流
E瓶的作用是_______。
(4)F中盛有碱石灰,其目的是_______(选填序号)。
a.吸收HCl b.吸收Cl2 c.吸收CO2 d.吸收H2O
(5)将D中固体改为市售氯化铝(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是_______。若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原市售氯化铝的40%,则可推算n的值为_______。
(6)有人建议将上述装置A、B中的试剂改为浓盐酸和二氧化锰,其余装置和试剂均不变, 也能制备无水AlCl3。事实证明这样做比较危险,请简述理由_______

完成下列填空:
(1)写出烧瓶中(B处)发生反应的化学方程式:_____________
(2)C中盛有的试剂为_____。进行实验时应先点燃_____(选填“B”或“D”)处酒精灯。
(3)用粗短导管连接D、E的目的是_______ (选填序号)。
a.防堵塞 b.防倒吸 c.平衡气压 d.冷凝回流
E瓶的作用是_______。
(4)F中盛有碱石灰,其目的是_______(选填序号)。
a.吸收HCl b.吸收Cl2 c.吸收CO2 d.吸收H2O
(5)将D中固体改为市售氯化铝(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是_______。若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原市售氯化铝的40%,则可推算n的值为_______。
(6)有人建议将上述装置A、B中的试剂改为浓盐酸和二氧化锰,其余装置和试剂均不变, 也能制备无水AlCl3。事实证明这样做比较危险,请简述理由_______
(1)NaCl + H2SO4(浓)
 NaHSO4 + HCl↑;
NaHSO4 + HCl↑;(2)浓硫酸,B;
(3)a;使AlCl3冷凝、收集AlCl3;
(4)ad;
(5)抑制AlCl3水解;4;
(6)制得的Cl2中混有HCl,与Al反应生成H2,H2与Cl2混合加热时会发生爆炸
试题分析:该实验的原理是先通过发生装置制备HCl气体,然后通过浓硫酸干燥气体,干燥的HCl再与Al反应,最后收集制得的AlCl3。
(1)实验室一般用浓硫酸和NaCl制备HCl气体。
(2)干燥HCl气体用浓硫酸。试验时,应先点燃B处酒精灯,使HCl气体充满装置,再加热D处,防止Al与空气中的O2反应。
(3)AlCl3升华后,易冷凝,若用细导管容易被堵塞。E瓶的作用是将AlCl3冷凝、收集。
(4)F中的碱石灰,可吸收多余的HCl气体,防止污染空气,还可以吸收空气中的水蒸气,防止水蒸气进入E瓶,使AlCl3水解。
(5)若用AlCl3·6H2O制备无水AlCl3,通入HCl是为了防止AlCl3水解。所得碱式氯化铝是原市售氯化铝质量的40%,则可知AlCl3·6H2O转化为Al2(OH)nCl(6-n)后,相对原子质量是原来的40%,即
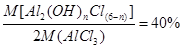 ,代入各原子的相对原子质量,可得n=4。
,代入各原子的相对原子质量,可得n=4。(6)二氧化锰和浓盐酸反应生成的Cl2中含有HCl,Al与HCl反应会生成H2,H2、Cl2混合加热容易发生爆炸。

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
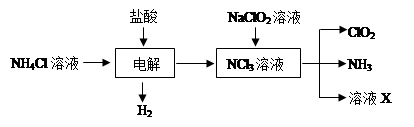
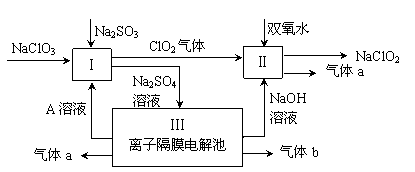
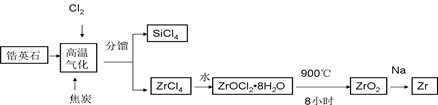
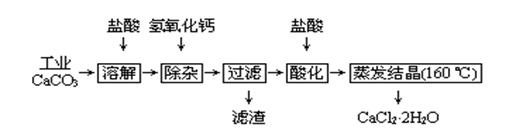
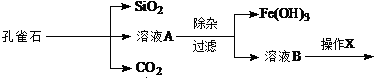
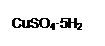 为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下: