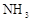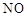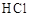题目内容
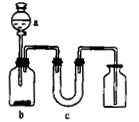
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
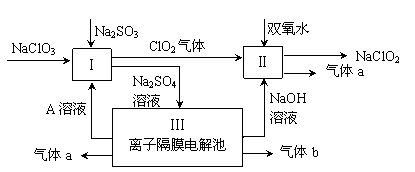
(1)双氧水的结构式为: ;Ⅰ中发生反应的还原剂是 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式 。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 (填相同、不相同或无法判断)

(1)双氧水的结构式为: ;Ⅰ中发生反应的还原剂是 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式 。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 (填相同、不相同或无法判断)
(14分)(1)H-O-0-H Na2SO3 (各2分)
(2)2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O(2分)
(3)H2SO4 阳(2分)
(4)5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑+ 2H2O。 (2分)
ClO2-+ 3Cl-+ 4H+ = 2Cl2+ 2H2O(2分)
(5)相同(2分)
(2)2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O(2分)
(3)H2SO4 阳(2分)
(4)5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑+ 2H2O。 (2分)
ClO2-+ 3Cl-+ 4H+ = 2Cl2+ 2H2O(2分)
(5)相同(2分)
试题分析:⑴H2O2中两个氧原子间形成一个共用电子对,结构式为:H―O―O―H,反应I:2ClO3―+SO32―+2H+=2ClO2+SO42―+H2O,其中SO32―中S由+4价变成+6价,作还原剂,格答案为:H―O―O―H;Na2SO3 ;⑵从图中读出反应物为ClO2和H2O2,碱性条件,产物为NaClO2,ClO2作氧化剂,H2O2中氧由―1价变成―2,2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O,故答案:2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O;⑶Ⅲ阳极:2H2O―4e―=4H+ +O2↑,a为O2,阴极:4H2O+4e―=4OH― +2H2↑, b为H2, A的化学式是H2SO4, 装置Ⅲ中A在阳极区产生,答案:H2SO4、阳;⑷Cl―浓度大时,还原性增强,被生成的ClO2氧化,5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑+ 2H2O、ClO2-+ 3Cl-+ 4H+ = 2Cl2+ 2H2O。答案为:5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑+ 2H2O、ClO2-+ 3Cl-+ 4H+ = 2Cl2+ 2H2O;⑸ClO2―、ClO3―与Fe2+ 反应最终都变成Cl―,变质前后转移的电子数相同,反以消耗Fe2+的物质的量相同。答案:相同。

练习册系列答案
相关题目