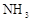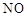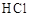题目内容
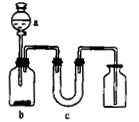
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:

(1)除去ClO2中的NH3可选用的试剂是 ;可用于制取NH3的是________(填序号)
(2)写出NaClO2溶液与NCl3溶液反应的化学方程式:__________________
(3)写出电解时阳极发生的电极反应式_
(4)测定ClO2的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去VmL硫代硫酸钠溶液。
①请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式
②测得ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)

(1)除去ClO2中的NH3可选用的试剂是 ;可用于制取NH3的是________(填序号)
| A.饱和食盐水 | B.碱石灰 | C.浓硫酸 | D.水 E.NH4HCO3 |
(3)写出电解时阳极发生的电极反应式_
(4)测定ClO2的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去VmL硫代硫酸钠溶液。
①请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式
②测得ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)
(1)C (2分);BE (2分)
(2)6NaClO2+NCl3+3H2O=6ClO2↑+NH3↑+3NaCl+3NaOH (3分)
(3)NH4++3Cl- -6e-=NCl3+4H+(3分)
(4)①2ClO2+10I-+8H+=2Cl-+5I2+4H2O (3分)
②1.35×10-2CV(g)(3分)
(2)6NaClO2+NCl3+3H2O=6ClO2↑+NH3↑+3NaCl+3NaOH (3分)
(3)NH4++3Cl- -6e-=NCl3+4H+(3分)
(4)①2ClO2+10I-+8H+=2Cl-+5I2+4H2O (3分)
②1.35×10-2CV(g)(3分)
试题分析:(1)ClO2 易溶于水,NH3 又显碱性,因此要除去混有的氨气,应该选择浓硫酸(2分);制备氨气可以选择铵盐和强碱制备。(2分)
(2)根据已给出的反应物和生成物中化合价判断该反应是个氧化还原反应,由于有氨气产生,所以反应物必然有H2O参加,相应的就会生成NaCl 、NaOH 。
(3)电解在酸性条件下进行,阴极发生还原反应析出H2,电极反应式:6H++6e-=3H2,阳极发生氧化反应,NH4+被氧化成NCl3 ,有H+生成,电极反应式:NH4++3Cl- -6e-=NCl3+4H+(3分)
(4)ClO2 有较强氧化性,把I- 氧化为I2 ,在酸性条件下,考虑有H+参加生成H2O (3分)
②根据反应方程式得出三者关系
ClO2 ~I2~S2O32-
2 : 5 :10
m(ClO2)=n(ClO2)×M(ClO2)=0.2n(S2O32-)×M(ClO2)=0.2×Cmol/L×V×10-3 L×67.5g/mol=1.35×10-2CV(g)(3分)

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目