题目内容
锆产业是极有发展潜力及前景的新兴产业,锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4),含Al2O3、SiO2、Fe2O3等杂质,生产锆流程之一如下:
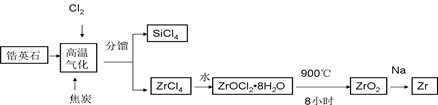
试回答下列问题:
(1)写出上述流程中高温气化的反应方程式(碳转化成CO): ;
(2)写出ZrOCl2?8H2O在900℃生成ZrO2的反应方程式 ;
(3)关于二氧化锆纳米陶瓷和锆合金的说法不正确的是 (单选);
(4)一种新型燃料电池,一极通入空气,另一极通入丁烷;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。在熔融电解质中,O2-向 (填正负)极移动。电池正极电极反应为: ,负极电极反应为: 。

试回答下列问题:
(1)写出上述流程中高温气化的反应方程式(碳转化成CO): ;
(2)写出ZrOCl2?8H2O在900℃生成ZrO2的反应方程式 ;
(3)关于二氧化锆纳米陶瓷和锆合金的说法不正确的是 (单选);
| A.二氧化锆纳米陶瓷是新型无机非金属材料 |
| B.1纳米=10-10米 |
| C.锆合金的硬度比纯锆要高 |
| D.日本福岛核电站的爆炸可能是由锆合金在高温下与水蒸气反应产生的氢气爆炸引起 |
(16分)
(1)4C+4Cl2+ZrSiO4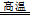 ZrCl4+SiCl4+4CO(3分)
ZrCl4+SiCl4+4CO(3分)
(2)ZrOCl2?8H2O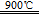 ZrO2+2HCl↑+7H2O↑(3分)
ZrO2+2HCl↑+7H2O↑(3分)
(3)B (2分)
(4)负(2分) O2 +4e-= 2O2-(3分)
C4H10 —26e-+13O2-=4CO2 +5H2O(3分)
(1)4C+4Cl2+ZrSiO4
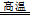 ZrCl4+SiCl4+4CO(3分)
ZrCl4+SiCl4+4CO(3分)(2)ZrOCl2?8H2O
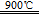 ZrO2+2HCl↑+7H2O↑(3分)
ZrO2+2HCl↑+7H2O↑(3分) (3)B (2分)
(4)负(2分) O2 +4e-= 2O2-(3分)
C4H10 —26e-+13O2-=4CO2 +5H2O(3分)
试题分析:(1)依题意,ZrSiO4、Cl2、C在高温下发生氧化还原反应,生成SiCl4、ZrCl4和CO,氯元素由0降为—1价,碳元素由0升为+2价,根据化合价升降总数相等、原子个数守恒,则该反应为ZrSiO4+4Cl2+4C
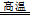 SiCl4+ZrCl4+4CO;(2)ZrOCl2?8H2O在900℃下发生分解反应,生成ZrO2、HCl、H2O,该反应不涉及氧化还原反应,设反应物的系数为1,根据原子个数守恒可得:ZrOCl2?8H2O
SiCl4+ZrCl4+4CO;(2)ZrOCl2?8H2O在900℃下发生分解反应,生成ZrO2、HCl、H2O,该反应不涉及氧化还原反应,设反应物的系数为1,根据原子个数守恒可得:ZrOCl2?8H2O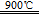 ZrO2+2HCl↑+7H2O↑;(3)陶瓷是传统无机非金属材料,二氧化锆纳米陶瓷是新型陶瓷,故A正确;纳米级二氧化锆是化合物或纯净物,它分散到空气或水中形成的分散系或混合物属于胶体,故B不正确;合金的硬度一般比其成分金属大,熔点比其成分金属低,故C正确;锆和铁都是过渡金属,铁在高温下与水蒸气发生置换反应,放出氢气,混有空气的氢气遇热可能爆炸,由此类比推断锆合金具有类似的性质,故D正确;(4)根据原电池原理,电子从负极出发经过外电路流向正极,则内电路中阴离子移向负极,阳离子移向正极,因此该熔融氧化物为电解质的新型电池中氧离子移向负极;依题意,正极的主要反应物是氧气,氧元素化合价由0降为—2价,1个氧原子得到2个电子,1个氧气分子得到4个电子,则正极反应式为O2 +4e-= 2O2-;负极的主要反应物和产物分别是甲烷和二氧化碳气体,即C4H10→4CO2;碳元素化合价总数由—10升为+16价,则1个丁烷分子失去26个电子,则C4H10—26e-→4CO2;左边带26个正电,右边不带电,根据熔融状态下能传导氧离子,因此用13个氧离子使左右电荷守恒,则C4H10—26e-+13O2-→4CO2;左边比右边多10个H、5个O,根据原子个数守恒配平可得负极反应式:C4H10—26e-+13O2-=4CO2+5H2O。
ZrO2+2HCl↑+7H2O↑;(3)陶瓷是传统无机非金属材料,二氧化锆纳米陶瓷是新型陶瓷,故A正确;纳米级二氧化锆是化合物或纯净物,它分散到空气或水中形成的分散系或混合物属于胶体,故B不正确;合金的硬度一般比其成分金属大,熔点比其成分金属低,故C正确;锆和铁都是过渡金属,铁在高温下与水蒸气发生置换反应,放出氢气,混有空气的氢气遇热可能爆炸,由此类比推断锆合金具有类似的性质,故D正确;(4)根据原电池原理,电子从负极出发经过外电路流向正极,则内电路中阴离子移向负极,阳离子移向正极,因此该熔融氧化物为电解质的新型电池中氧离子移向负极;依题意,正极的主要反应物是氧气,氧元素化合价由0降为—2价,1个氧原子得到2个电子,1个氧气分子得到4个电子,则正极反应式为O2 +4e-= 2O2-;负极的主要反应物和产物分别是甲烷和二氧化碳气体,即C4H10→4CO2;碳元素化合价总数由—10升为+16价,则1个丁烷分子失去26个电子,则C4H10—26e-→4CO2;左边带26个正电,右边不带电,根据熔融状态下能传导氧离子,因此用13个氧离子使左右电荷守恒,则C4H10—26e-+13O2-→4CO2;左边比右边多10个H、5个O,根据原子个数守恒配平可得负极反应式:C4H10—26e-+13O2-=4CO2+5H2O。
练习册系列答案
相关题目