题目内容
6.下列叙述正确的是( )| A. | 某有机物分子中无支链,其名称为“乙×”,则该有机物的一个分子中一定含两个碳原子 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 应用盖斯定律,可以计算某些难于直接测量的反应的反应热 | |
| D. | △H小于零的反应是放热反应,这类反应的平衡常数K一般都大于1 |
分析 A.某有机物分子中无支链,其名称为“乙×”,不能确定该有机物的一个分子中一定含两个碳原子;
B.反应速率与反应是吸热还是放热无关;
C.反应的热效应只与始态、终态有关,与过程无关;
D.△H小于零的反应是放热反应,但与平衡常数大小无关.
解答 解:A.某有机物分子中无支链,其名称为“乙×”,不能确定该有机物的一个分子中一定含两个碳原子,例如乙醚就含有4个碳原子,故A错误;
B.反应速率与反应是吸热还是放热无关,故B错误;
C.反应的热效应只与始态、终态有关,与过程无关,根据盖斯定律可计算某些难以直接测量的反应焓变,故C正确;
D.△H小于零的反应是放热反应,但与平衡常数大小无关,故D错误;
故选C.
点评 本题考查有机物的名称、影响反应速率的因素、盖斯定律、平衡常数等,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | 原子的最外层电子数相同的元素,一定属于同一族 | |
| B. | 电子层数相同的粒子,对应元素一定属于同一周期 | |
| C. | 元素周期表中元素排序的依据是原子的核电荷数 | |
| D. | 元素周期表中有十六个纵行,也就是十六个族 |
17.下列描述,其因果关系成立的是( )
| A. | 因为酸性HF>HCl,所以非金属性F>Cl | |
| B. | 因为SO2、Cl2都有漂白性,所以二者混合使用漂白有色物质,效果会更好 | |
| C. | 因为某物质的焰色反应呈黄色,所以其一定是含Na元素的化合物 | |
| D. | 因为烯烃的通式为CnH2n,不同烯烃的实验式相同,所以烯烃的含碳量为一常数 |
14.0.1mol/L NH4Cl溶液中,由于NH4+的水解,使得c (NH4+)<0.1mol/L.如果要使c (NH4+)更接近于0.1mol/L,可采取的措施是( )
| A. | 加入少量氢氧化钠 | B. | 加入少量盐酸 | ||
| C. | 加入少量水 | D. | 加热 |
1.已知下列热化学方程式:
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
现有0.2mol的炭粉和氢气组成的气、固混合物在氧气中完全燃烧,共放出63.53kJ热量,则炭粉与氢气的物质的量之比为( )
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
现有0.2mol的炭粉和氢气组成的气、固混合物在氧气中完全燃烧,共放出63.53kJ热量,则炭粉与氢气的物质的量之比为( )
| A. | 1:1 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
11.下列各组离子能在溶液中大量共存,且溶液呈碱性、透明的是( )
| A. | AlO2-、K+、CO32-、Na+ | B. | Na+、OH-、H2PO4-、NO3- | ||
| C. | Al3+、Cl-、CO32-、Na+ | D. | Fe2+、K+、H+、NO3- |
16.下列说法正确的是( )
| A. | 含有共价键的化合物必是共价化合物 | |
| B. | 阴、阳离子间通过静电引力所形成的化学键是离子键 | |
| C. | 化学变化过程,一定会破坏旧的化学键,同时形成新的化学键 | |
| D. | 液态氯化氢中存在H+和Cl-,所以能导电 |
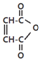 是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径:
是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径: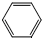 而不是
而不是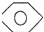 ,即假定苯仍具有普通烯烃的性质,则一分子该“环己三烯”在催化剂作用下与一分子H2发生加成反应后产物分子的结构简式是
,即假定苯仍具有普通烯烃的性质,则一分子该“环己三烯”在催化剂作用下与一分子H2发生加成反应后产物分子的结构简式是 或
或 .
.