题目内容
氯气是一种重要的化工原料。某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
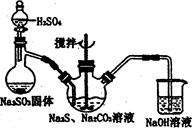
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有
;
(2)装置A中盛有的试剂是 ,作用是 。
(3)若D中品红溶液褪色,则B装置中发生反应的离子方程式是
(4)证明FeBr2与Cl2发生了氧化还原反应的实验方法是 (填操作方法)。
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气。经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32- 和SO42-,对于可能存在的其他阴离子,研究小组提出以下3种假设。假设1:只存在SO32-;假设2:只存在ClO-;假设3:既不存在SO32-,也不存在ClO-。
(5)学习小组判断同时存在SO32-和ClO-是不可能的理由是 。
38.现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论。
a.3 mol/L H2SO4
b.0.01 mol/L KMnO4
c.1 mol/L BaCl2溶液
d.淀粉碘化钾溶液
e.酚酞试液
步骤一;取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B
两试管中。
步骤二:向A试管中滴加少量___________ (填序号),若溶液_________________(填现象),则假设
1成立。
步骤三:向B试管中滴加少量___________(填序号),若溶液_________________(填现象),则假设2
成立。
(1)分液漏斗,酒精灯 (各1分,共2分)
(2)饱和食盐水,除去氯气中的氯化氢 (各1分,共2分)
(3)2Fe2+ + 4Br-+ 3Cl2 →2Fe3+ + 6 Cl-+ 2 Br 2 (2分)
(4)实验后,取少量B中溶液,滴加KSCN溶液;另取少量B中溶液,加入CCl4溶液萃取。(1分)
(5)SO32-和ClO-因发生氧化还原反应,故不能共存 (1分)
38. b ,褪色 ;d ,变蓝色 (各1分,共4分)
解析试题分析:(1)二氧化锰和浓盐酸反应制取氯气的方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,从方程式可知该反应需加热,因此需酒精灯,反应物浓盐酸的滴加以及防氯气的逸出还需要分液漏斗。
MnCl2+Cl2↑+2H2O,从方程式可知该反应需加热,因此需酒精灯,反应物浓盐酸的滴加以及防氯气的逸出还需要分液漏斗。
(2)由于浓盐酸易挥发,所以生成的氯气中含有氯化氢杂质,所以当含氯化氢的氯气通过饱和食盐水时,氯化氢溶解在其中,氯气几乎不溶,这样可以除去氯气中的氯化氢杂质。
(3)氯气溶于水生成的次氯酸具有漂白性,所以若D中品红溶液褪色,说明经过D中有氯气,经过D中有氯气说明B装置中,溴化亚铁中的二价铁和溴离子均被氧化,发生反应的离子方程式为2Fe2++4Br-+3Cl2→2Fe3++6Cl-+2Br2。
(4)由于亚铁离子的还原性强于溴离子的,所以FeBr2与Cl2发生氧化还原反应时,溴化亚铁中的二价铁先被氧化,所以只须证明有三价铁存在即可。KSCN溶液可与三价铁形成血红色的硫氰化铁可证明有三价铁存在。另外也可以证明有溴单质生成,因此正确的操作应该是实验后,取少量B中溶液,滴加KSCN溶液;另取少量B中溶液,加入CCl4溶液萃取。
(5)ClO-中+1价的氯具有强氧化性,SO32-中+4价的硫具有还原性,ClO-与SO32-会发生氧化还原反应,所以二者不能大量共存。
38.步骤二 中KMnO4 具有强氧化性与具有还原性的SO32-发生氧化还原反应KMnO4褪色;步骤三中ClO-中+1价的氯具有强氧化性,能将碘化钾中-1价的碘氧化成碘单质.淀粉遇到碘单质显蓝色。
考点:考查氯气的制备、除杂、性质探究、物质检验以及实验方案设计与评价等

 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)乙中反应的离子方程式为 。
(2)乙中生成的气体除N2和CO2外,还有副产物HCl及Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。则丙中加入的除杂试剂是___________(填字母)
| A.饱和食盐水 | B.饱和NaHCO3溶液 | C.浓NaOH溶液 | D.浓硫酸 |
装有碱石灰的干燥管的作用是 。
(4)戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 。若该测得值与实际处理的百分率相比偏低,请简要说明可能的任意一个原因 。
(5)请提出一个能提高准确度的建议(要有可操作性,不宜使操作变得过于复杂) 。
废易拉罐的成分比较复杂,据查,铝易拉罐各部分成分及含量(质量百分含量)见表:
| | Si | Fe | Cu | Mn | Mg | Cr | Zn | Ti | Al |
| 罐身/% | 0.3 | 0.7 | 0.25 | 0.25 | 1.0~1.5 | | | | 其余 |
| 罐盖/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 4.0~5.0 | | 0.1 | 0.25 | 其余 |
| 拉环/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 3.0~4.0 | 0.1 | 0.25 | 0.1 | 其余 |
为了验证罐身的组成成分,进行了如下实验:
【实验仪器与药品】
仪器:酒精灯、烧杯、试管、试管夹、漏斗、滤纸、铁圈、玻璃棒、砂纸、剪刀
药品:易拉罐、去污粉、NaOH溶液、KSCN溶液、盐酸、镁试剂、高碘酸(H3IO6,弱酸)
【实验方案】
实验预处理:将剪好的易拉罐片用砂纸打磨,除去表面的涂料层,直到光亮后用去污粉清洗干净备用。
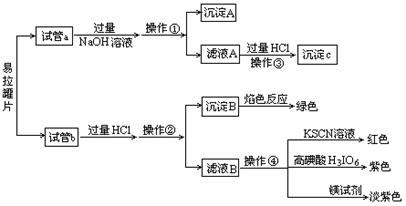
【实验过程】分别向试管a、b中加入少量上述易拉罐片,进行如下操作:
请填写下列空白:
(1)图中操作①②所用到的玻璃仪器有 。
(2)沉淀A的成分为 。
(3)操作③观察到的现象为 ;反应的离子方程式为 、
、 。
(4)若试管a、b中取样相同,则分别加入足量的NaOH溶液、稀盐酸后,相同条件下理论上产生的气体体积V(a) V(b)(填“>”、“<”或“=”)
有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验。按右表所示的量和反应条件在三颈瓶中加入一定量P2O5,并注入95%的乙醇,并加热,观察现象。
| 实验 | P2O5 /g | 95%乙醇量/ mL | 加热方式 |
| 实验1 | 2 | 4 | 酒精灯 |
| 实验2 | 2 | 4 | 水浴70℃ |

实验结果如下:
| 实验 | 实验现象 | ||
| 三颈瓶 | 收集瓶 | 试管 | |
| 实验1 | 酒精加入时,立刻放出大量的白雾,开始有气泡产生,当用酒精灯加热时,气泡加快生成并沸腾,生成粘稠状液体。 | 有无色液体 | 溶液褪色 |
| 实验2 | 酒精加入时,有少量白雾生成,当用水浴加热时,不产生气泡,反应一个小时,反应瓶内生成粘稠状液体 | 有无色液体 | 溶液不褪色 |
根据上述资料,完成下列填空。
(1)写出乙醇制乙烯的化学方程式 。
(2)上图装置中泠凝管的作用是___________,进水口为(填“a”或“b”)______,浓硫酸的作
用是 。
(3)实验1使溴的四氯化碳溶液褪色的物质是___________。
(4)实验2中,水浴加热所需仪器有 、 (加热、夹持仪器、石棉网除外)。
(5)三颈瓶、收集瓶中的液体经检验为磷酸三乙酯,写出三颈瓶中生成磷酸的化学方程式
_____________________,P2O5在实验1中的作用是______________________ 。
(6)根据实验1、2可以推断:
①以P2O5作为催化剂获得乙烯的反应条件是____________
②P2O5与95%乙醇在加热条件下可以发生的有机反应的类型是________反应。
实验室以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)为原料制取CaCl2·H2O和CaO2的主要流程如下: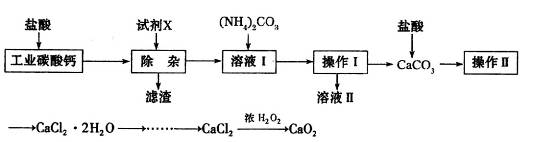
(1)加入试剂X,调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,滤渣的主要成分是___________。试剂X可以选择下列的________(填编号)。
| A.CaO | B.CaCO3 | C.NH3·H2O | D.Ba(OH)2 |
(3)由CaCl2制取CaO2的反应中,温度不宜太高的原因是_______________。
(4)用下列装置测定工业碳酸钙的质量分数
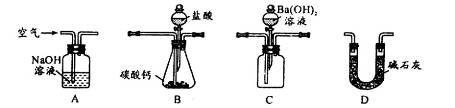
①检验装置B气密性良好的实验过程是__________________________。
②按A—B—C—D顺序连接,然后从A装置通入空气,目的是_______________。
③装置D的作用为______________________。
④实验时,准确称取10.00g工业碳酸钙3份,进行3次测定,测得BaCO3沉淀的平均质量为17.73g,则样品中CaCO3的质量分数为__________________。